
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:褪黑素与干细胞血管生成潜能
【字体: 大 中 小 】 时间:2025年08月07日 来源:Stem Cell Research & Therapy 7.3
编辑推荐:
这篇综述系统探讨了褪黑素(melatonin, Mel)在调节干细胞(尤其是间充质干细胞MSCs和内皮祖细胞EPCs)血管生成(angiogenesis)中的作用,重点阐述了其通过MT1/MT2受体、SIRT1/PGC-1α等通路在缺血性疾病(如心肌梗死MI)中的双重调控机制,为开发新型联合治疗方案提供了理论依据。
褪黑素的生物合成与生物学特性
褪黑素(N-乙酰-5-甲氧基色胺)作为起源于25亿年前的古老分子,在松果体细胞中由色氨酸经羟基化、脱羧和乙酰化等步骤合成。这种脂溶性分子具有独特的昼夜节律分泌特性,70%通过白蛋白运输至全身组织。其多效性功能包括:
强效抗氧化:清除ROS(活性氧簇)和NO代谢物
免疫调节:抑制炎症因子如TNF-α、IL-6
促血管生成:调控VEGF、FGF、HGF等生长因子分泌
抗衰老:通过Sirtuins家族延缓细胞衰老

血管生成与血管发生的调控机制
在缺血性疾病中,血管新生通过两种主要方式完成:
血管生成(Angiogenesis)
成熟内皮细胞(ECs)在VEGF/VEGFR、Ang/Tie-2等信号激活下,经历增殖→迁移→管腔形成过程。其中:
VEGF/VEGFR-2轴促进EC增殖
Ang-1通过招募周细胞稳定新生血管
FGF协同VEGF增强血管网络构建
血管发生(Vasculogenesis)
骨髓来源的内皮祖细胞(EPCs)通过CXCR4/SDF-1α通路归巢至缺血部位,分化为成熟ECs(CD31+/vWF+),并分泌促血管因子。
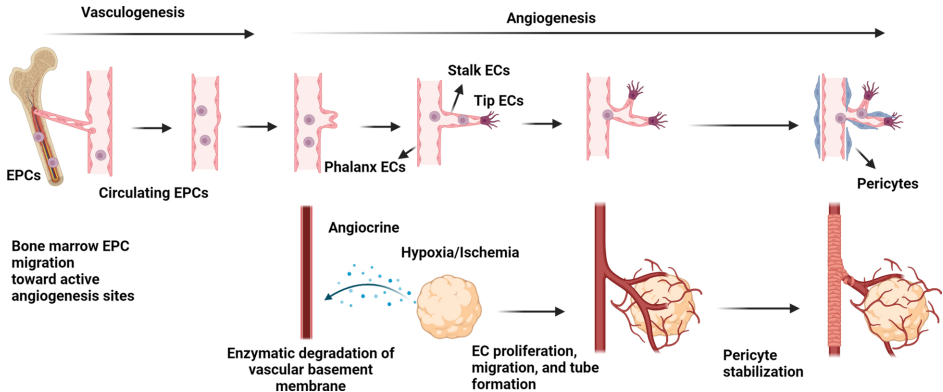
干细胞在血管再生中的关键作用
间充质干细胞(MSCs)和EPCs通过以下机制促进血管再生:
直接分化:MSCs可转分化为功能性ECs
旁分泌作用:分泌VEGF、IGF-1等促血管因子(浓度可达正常水平3倍)
外泌体递送:携带miR-29b-3p等调控RNA
免疫调节:促进M2型巨噬细胞极化
但移植后存活率低(约80%细胞72小时内凋亡)是主要瓶颈,这与缺血微环境中的氧化应激和营养缺乏密切相关。
褪黑素调控干细胞血管生成的双重效应
促血管生成机制:
细胞保护作用
通过MT1/MT2受体激活PI3K/Akt通路
使SOD、过氧化氢酶等抗氧化酶活性提升2-3倍
降低凋亡标志物caspase-3表达达50%
功能增强作用
上调PGC-1α使VEGF分泌增加1.8倍
通过SIRT1去乙酰化FOXO1增强EPCs迁移能力
促进LC3-II介导的自噬流清除受损线粒体
外泌体调控
褪黑素预处理的MSCs外泌体具有:
抗炎特性(IL-10↑2倍,TNF-α↓60%)
促血管因子富集(HGF↑45%,bFGF↑30%)
抗血管生成机制:
高剂量(>50μM)褪黑素可通过:
抑制HIF-1α核转位使VEGF表达降低40%
减少CD34+/CD133+ EPCs归巢
阻断STAT3/CBP/p300复合物形成

治疗应用前景
在心肌梗死模型中,褪黑素联合干细胞治疗可:
使梗死区毛细血管密度提高2.3倍
减少纤维化面积达50%
改善心功能指标EF值15-20%
在糖尿病伤口模型中,通过AMPK/mTOR通路:
加速上皮再生速度40%
增加α-SMA+小动脉数量
胶原沉积减少35%
现存挑战与展望
剂量依赖性效应(治疗窗窄)、给药时机选择(缺血后6小时黄金期)、载体系统开发(如PLGA纳米粒缓释)是当前主要挑战。未来研究应聚焦:
单细胞测序解析EC亚群异质性
类器官模型模拟3D血管网络构建
人工智能预测最佳联合治疗方案
这种"干细胞+褪黑素"的协同策略,为缺血性疾病治疗提供了新的再生医学范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘