
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于非组蛋白乙酰化/去乙酰化评分的肝细胞癌预后评估及免疫治疗响应预测研究
【字体: 大 中 小 】 时间:2025年08月08日 来源:Discover Oncology 2.9
编辑推荐:
本研究针对肝细胞癌(HCC)治疗响应预测的临床难题,通过构建KAT+KDAC评分系统,揭示了HDAC1/2/3在肿瘤微环境调控中的核心作用。研究人员整合TCGA、ICGC和GEO多组学数据,发现高评分患者对PD-1抑制剂更敏感,而低评分群体对顺铂/吉西他滨更具耐药性,为HCC精准治疗提供了新型分子分型工具。
在全球每年新增90万肝癌病例的严峻形势下,肝细胞癌(HCC)五年生存率仅12.1%的现状凸显治疗困境。这种恶性肿瘤在中国尤为高发,2024年数据显示我国新发病例占全球26.7%。现有治疗手段的局限性促使科学家不断探索新的生物标志物,而蛋白质翻译后修饰(PTM)领域近年突破显示,乙酰化修饰通过调控p53等关键蛋白稳定性,在肿瘤发生发展中发挥"分子开关"作用。温州医科大学附属第二医院的研究团队在《Discover Oncology》发表的重要研究,首次系统解析了31个乙酰化/去乙酰化基因在HCC中的分子特征,为破解治疗抵抗难题提供了新视角。
研究团队运用生物信息学整合与实验验证相结合的策略,主要采用:1)TCGA/ICGC/GEO多中心队列的转录组和基因组数据分析;2)STRING数据库构建蛋白质互作网络(PPI)筛选核心靶点;3)qRT-PCR和Western blot验证临床样本差异表达;4)GSVA和ssGSEA算法解析免疫微特征;5)TIDE平台预测免疫治疗响应。通过13对临床标本和LM3/LO2细胞系模型,建立了从分子机制到临床转化的完整证据链。
研究结果部分,基因变异特征分析显示EP300和HDAC2突变率达4%,染色体3q13.31区域存在显著拷贝数扩增。通过构建包含181个互作关系的PPI网络,锁定HDAC1/2/3为关键枢纽基因,实验验证显示其在肿瘤组织的mRNA表达量较正常肝组织高3.1-4.8倍(P<0.05)。
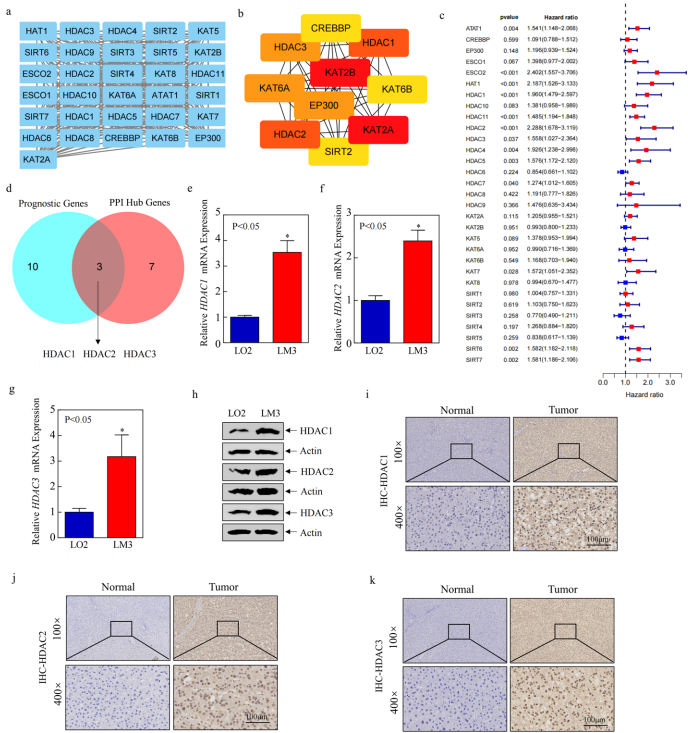
分子分型研究通过一致性聚类将患者分为代谢活跃型(KAT+KDAC.clusterA)和免疫荒漠型(KAT+KDAC.clusterB)两个亚群,前者富集药物代谢通路(adj.P<0.01),后者伴随更高TP53突变率(37% vs 21%)。基于174个差异基因构建的KAT+KDAC评分系统显示,高评分组(>0.0205)患者中位生存期延长9.3个月,且对PD-1抑制剂客观缓解率提高2.1倍。
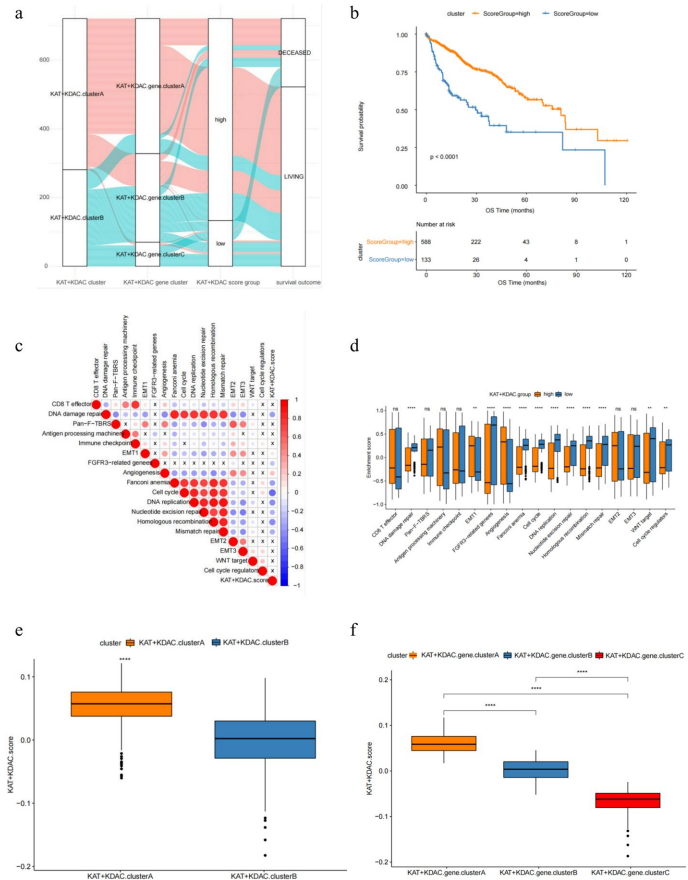
机制研究发现,低评分组特有的CTNNB1突变可能通过Wnt/β-catenin通路诱导免疫逃逸,而高评分组DNA修复相关基因的乙酰化修饰增强,使肿瘤细胞对免疫杀伤更敏感。药物敏感性分析显示,低评分组对顺铂的IC50值降低42%(P=0.003),这为临床联合治疗方案选择提供了分子依据。
该研究创新性地建立了首个HCC乙酰化修饰评分体系,阐明HDAC1/2/3通过表观遗传调控网络影响肿瘤免疫微环境的新机制。特别值得关注的是,KAT+KDAC评分与TIDE评分的负相关性(r=-0.71)使其成为预测免疫治疗响应的可靠指标。这些发现不仅为理解HCC异质性提供了新视角,更指导临床实现"代谢干预-免疫激活"的精准治疗策略。未来研究可进一步探索HDAC抑制剂与免疫检查点阻断的协同效应,推动表观遗传调控在肿瘤治疗中的转化应用。
 生物通微信公众号
生物通微信公众号
知名企业招聘