
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:重新定义磷酸果糖激酶-1:通过多维调控网络协调癌症特征的多功能代谢枢纽
【字体: 大 中 小 】 时间:2025年08月08日 来源:Journal of Translational Medicine 7.5
编辑推荐:
这篇综述系统阐述了PFK-1(磷酸果糖激酶-1)在肿瘤中的多维调控机制,突破其传统糖酵解限速酶认知,揭示其通过亚型特异性调控(PFKP/PFKL/PFKM)、表观遗传重塑(如m6A修饰)、翻译后修饰(如Y64磷酸化)及亚细胞定位动态变化(核内转录调控/线粒体脂代谢)等机制,整合代谢重编程与致癌信号通路(PI3K/AKT、Wnt/β-catenin),驱动肿瘤增殖、转移、免疫逃逸等恶性表型,为靶向PFK-1的精准治疗提供新视角。
重新定义PFK-1的肿瘤生物学角色
磷酸果糖激酶-1(PFK-1)作为糖酵解核心限速酶,近年来其功能已超越经典代谢调控范畴,成为肿瘤恶性进展的多维调控枢纽。三种组织特异性亚型——血小板型(PFKP)、肝脏型(PFKL)和肌肉型(PFKM)——通过动态表达重编程、翻译后修饰网络和亚细胞定位转换,协同塑造肿瘤的代谢可塑性。
分子调控网络的多元维度
在转录层面,PFK-1亚型受缺氧诱导因子HIF-1α和表观遗传机制(如m6A甲基化)精细调控。例如,肺癌中缺氧通过HIF-1α上调PFKP表达,而肝癌中YTHDF3通过识别PFKL mRNA的m6A位点增强其稳定性。翻译后修饰(PTMs)赋予PFK-1代谢-信号双重功能:GBM中AKT介导的PFKP Ser386磷酸化可抵抗泛素化降解,而OC中NOS1介导的PFKM Cys351亚硝基化能稳定四聚体结构。
亚细胞定位的动态变化打破代谢酶仅存于胞质的传统认知。T-ALL中Cyclin D3/CDK6复合物磷酸化PFKP导致其核转位,与c-Myc协同激活CXCR4转录驱动转移;DCIS复发模型中,PFKL从核仁向质膜的动态迁移与代谢适应增强相关。
协调癌症标志性特征的核心机制
PFK-1通过多维度机制驱动肿瘤恶性表型:
• 增殖信号维持:PFKP在NSCLC中通过circLDLRAD3/miR-497-5p轴促进糖酵解,而PFKL在CRC通过TAp73转录激活维持增殖。
• 凋亡抵抗:PFKP通过NF-κB上调ABCC2介导肺癌顺铂耐药,PFKL在LSCC中增强糖酵解依赖的DNA修复。
• 血管生成:PFKP Y64磷酸化通过AKT/HIF-1α轴激活VEGF信号,而PFKM乳酰化通过微环境重塑间接调控血管生成。
• 免疫逃逸:PFKP通过EGFR信号上调PD-L1促进GBM免疫抑制,PFKM则通过TLR5/AKT2通路诱导M1型巨噬细胞极化。
临床转化的挑战与机遇
PFK-1表达谱与癌症诊断预后显著相关:PFKP高表达与NSCLC不良预后相关,其启动子高甲基化可作为HCC早期诊断标志物。亚型特异性PTM网络(如PFKP S386磷酸化)为组织选择性治疗策略开发提供新靶点。当前瓶颈在于缺乏修饰位点特异性抑制剂,未来需结合空间多组学技术解析亚型动态互作网络,开发靶向PFK-1信号转导功能的精准干预手段。
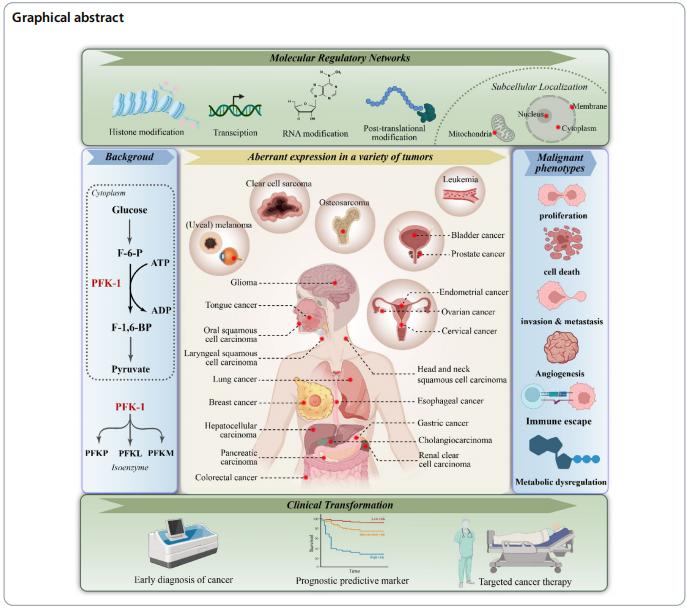
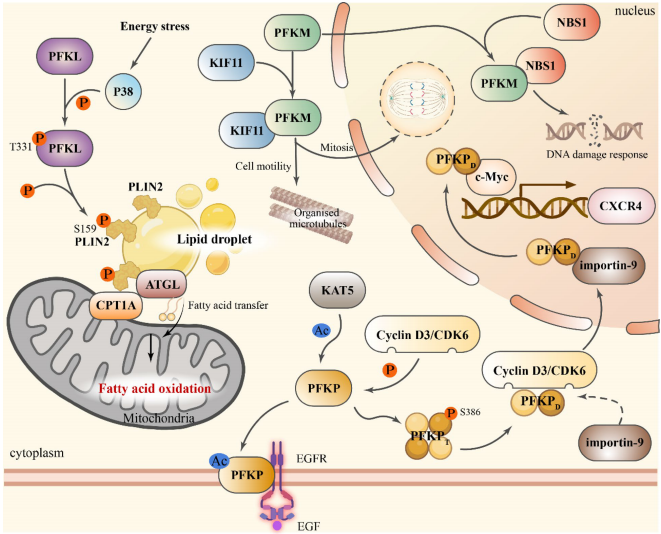
这一系统性研究不仅重新确立了PFK-1在肿瘤代谢可塑性中的核心地位,更为克服癌症治疗耐药性提供了全新视角——通过靶向代谢酶的非经典功能实现"精准代谢干预"。
 生物通微信公众号
生物通微信公众号
知名企业招聘