
-

生物通官微
陪你抓住生命科技
跳动的脉搏
时变刺激延长IKK激活促进核重塑和NF-κB动态机制转换
【字体: 大 中 小 】 时间:2025年08月09日 来源:Nature Communications 15.7
编辑推荐:
本研究通过机器人控制的微流控细胞培养系统,揭示了时间依赖性细胞因子刺激如何通过延长IKK(IkB激酶)在受体复合物(CI)中的组装时间,诱导NF-κB(核因子κB)核滞留的机制转换。研究人员发现脉冲式刺激通过染色质重塑(H3K4me3修饰)暴露新DNA结合位点,使NF-κB核输出从一级动力学转为伪零级动力学,突破传统"面积法则"限制。该成果发表于《Nature Communications》,为炎症性疾病和癌症治疗提供新靶点。
在细胞信号传导领域,NF-κB(核因子κB)转录因子被称为"分子交响乐指挥家",它能协调数百个基因的表达来调控炎症、免疫和细胞存活。然而长久以来,科学家们面临一个核心谜题:为何短暂脉冲式的细胞因子刺激(如IL-1β)有时比持续刺激更能引发强烈的基因应答?这个现象挑战了传统的"面积法则"(即信号强度取决于刺激剂量与时间的乘积)。更令人困惑的是,单细胞研究显示,即使接受相同刺激,相邻细胞的NF-κB响应也存在显著差异。这些未解之谜阻碍着人们对炎症性疾病和癌症中信号网络失调的理解。
美国匹兹堡大学(University of Pittsburgh)的研究团队在《Nature Communications》发表的研究给出了突破性答案。他们构建了双报告基因的U2OS骨肉瘤细胞系,通过CRISPR技术在内源位点标记IKK调控亚基NEMO(EGFP-NEMO)和NF-κB亚基RelA(mCherry-RelA)。借助自主设计的机器人微流控系统(DSS),研究人员实现了对单细胞同时进行IKK复合体成像和NF-κB核转位监测。
关键技术包括:(1)定制重力泵微流控系统实现精确时变刺激(单脉冲与脉冲序列);(2)活细胞成像追踪EGFP-NEMO形成的CI样组装体(complex I-like assemblies)动态;(3)粒子群优化算法(PSO)构建D2FC2数学模型;(4)荧光漂白恢复(FRAP)技术量化NF-κB-DNA结合;(5)组蛋白修饰(H3K4me3)免疫荧光检测染色质开放性。
IL-1脉冲持续时间与IKK-NF-κB响应的单调相关性
通过6-30分钟单脉冲刺激发现,EGFP-NEMO斑点数量与核mCh-RelA的曲线下面积(AUC)呈严格单调关系(Spearman ρ=0.76)。
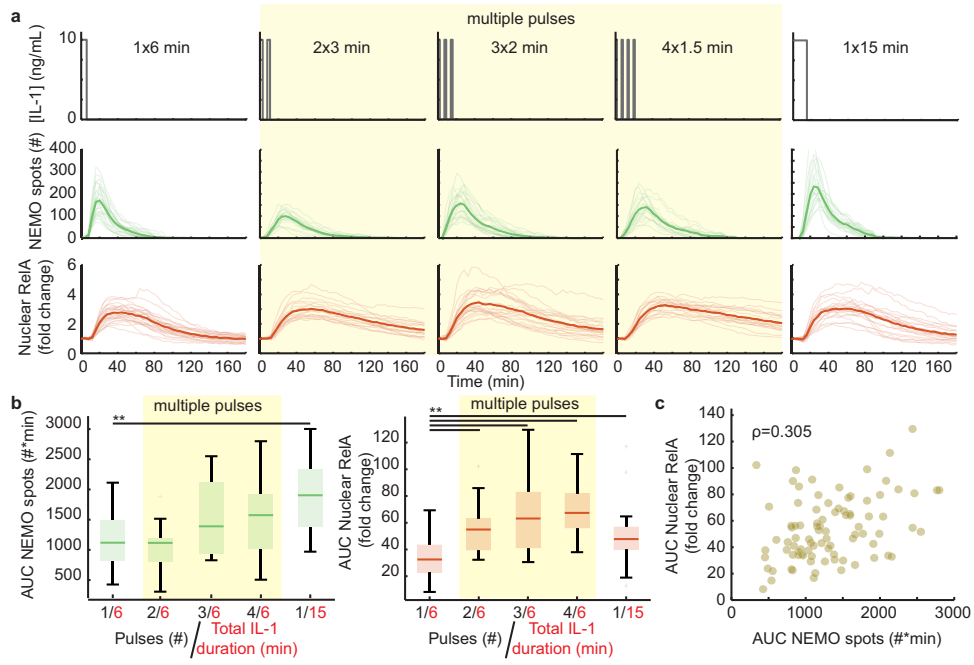
细胞因子脉冲序列引发超预期NF-κB响应
将6分钟单脉冲分割为4×1.5分钟脉冲(总剂量守恒)后,出现惊人现象:尽管IKK组装体AUC仅轻微增加,核RelA的AUC却提升2倍以上,甚至超过15分钟单脉冲效果。
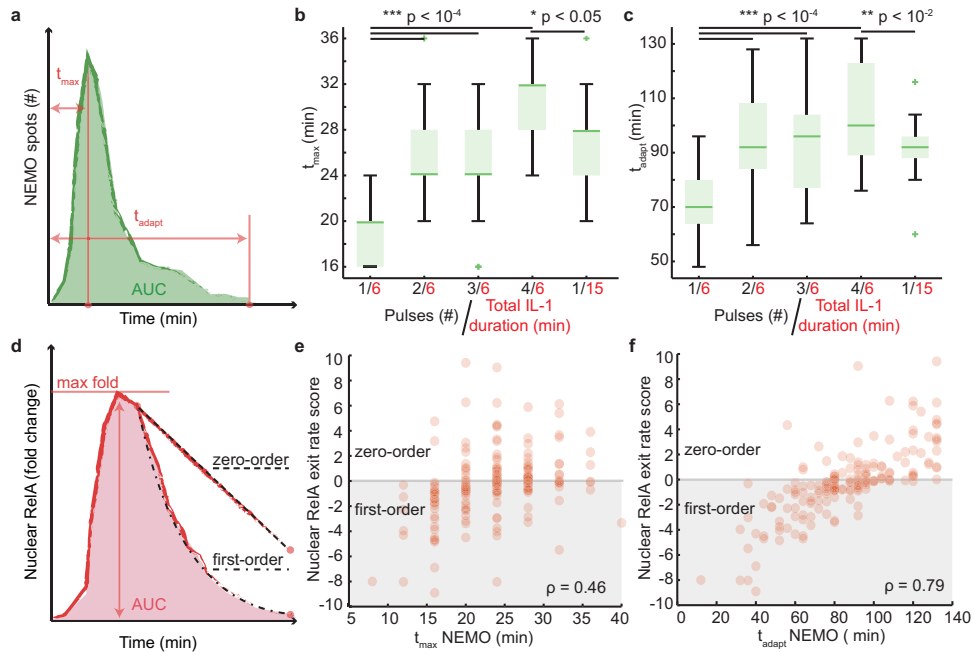
延长NEMO斑点适应时间改变NF-κB核输出机制
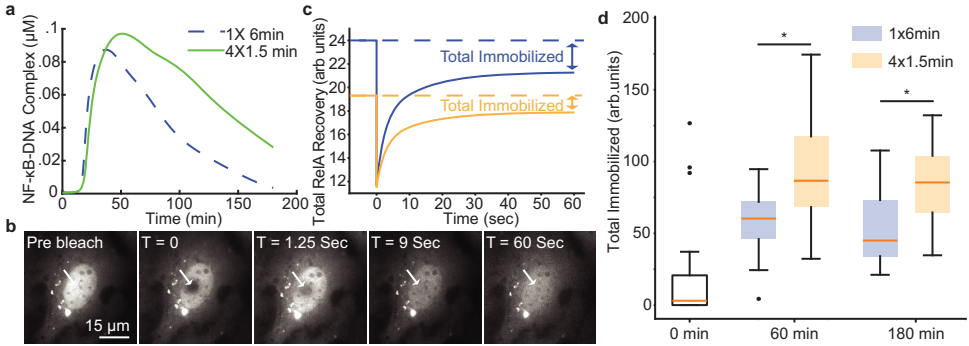
当EGFP-NEMO斑点持续超过80分钟时(tadapt),核RelA出口速率评分与零阶动力学显著相关(图3f)。FRAP实验证实,4×1.5分钟脉冲使NF-κB-DNA结合量在180分钟时仍保持高位(p=0.002),
染色质重塑模型再现涌现特性
基础D2FC模型无法解释脉冲序列效应,而引入染色质开放(NPio)和DNA结合(NFkBDNA)机制的D2FC2模型成功预测所有实验现象。

H3K4me3修饰验证染色质重塑
MLL1抑制剂OICR-9429处理可阻断脉冲序列诱导的H3K4me3增加(p=10-6),

这项研究揭示了时间编码的细胞信号传导新范式:脉冲式刺激通过延长IKK在CI组装体的驻留时间(>80分钟),触发染色质重塑(H3K4me3修饰)和NF-κB-DNA结合位点暴露,形成"分子海绵"效应。这种双机制模型解释了为何有限受体资源下,动态刺激能突破传统面积法则,为设计时序依赖性抗炎疗法提供理论依据。该成果还证明单细胞响应差异主要源于受体水平变异,为精准干预信号网络提供新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘