
-

生物通官微
陪你抓住生命科技
跳动的脉搏
ATP变构调控酰基辅酶A氧化酶活性:连接细胞能量状态与代谢调控的新机制
【字体: 大 中 小 】 时间:2025年08月09日 来源:Nature Communications 15.7
编辑推荐:
本研究揭示了ATP通过变构调控机制增强线虫酰基辅酶A氧化酶(ACOX-1.1)与FAD辅因子的结合能力,从而激活脂肪酸β-氧化和信息素生物合成通路。研究人员通过X射线晶体学、分子动力学模拟和酶动力学分析,首次发现ATP通过独特的螺旋束移位机制进入酶活性中心,形成连接ATP与FAD结合位点的变构网络。该发现为理解能量代谢与次级代谢的耦合调控提供了新视角,论文发表于《Nature Communications》。
在生命体的代谢调控网络中,能量货币ATP的浓度波动如何影响其他代谢通路一直是个未解之谜。特别引人关注的是,那些不直接消耗ATP的氧化还原酶类——比如依赖FAD(黄素腺嘌呤二核苷酸)的酰基辅酶A氧化酶(ACOX),是否也会受到ATP的调控?这个问题在秀丽隐杆线虫(C. elegans)中显得尤为关键,因为该生物的ACOX酶不仅参与脂肪酸β-氧化,还控制着决定群体行为的ascaroside信息素合成。
佛罗里达大学的研究团队在《Nature Communications》发表的研究揭开了这个谜题。他们发现ATP能特异性地结合到ACOX-1.1酶的二聚体界面,通过前所未有的变构机制将酶对FAD的结合亲和力提高30倍,使催化效率倍增。这种调控具有高度特异性——其他核苷酸如GTP、ADP等均不能替代ATP的作用,而ATP结合位点突变体则完全丧失响应能力。
研究主要运用了以下关键技术:X射线晶体学解析apo和holo酶的三维结构;分子动力学模拟(累计80μs轨迹)揭示ATP结合通道的开闭机制;荧光偏振法测定FAD解离常数(koff);酶偶联动力学分析建立ATP/ADP浓度与酶活性的定量关系。
ATP调控FAD结合的分子机制
晶体结构显示ATP结合位点深埋在二聚体界面,与FAD位点相邻但不相通。分子动力学模拟发现apo酶中αM-αN螺旋束的协同运动能打开直径达12?的通道,使ATP得以进出。变构网络分析鉴定出关键残基R343形成氢键桥,将ATP的核糖2'-羟基与FAD的磷酸基团相连。
能量代谢与酶活性的耦合
酶动力学实验揭示ATP能将FAD结合的EC50从13μM降至385nM,接近细胞内FAD生理浓度。这种调控具有双相特征:约50%酶分子形成高亲和力状态(KD=450nM),其余保持低亲和力,解释了天然酶制剂中观察到的异质性。
变构网络的破坏效应
关键节点突变体R343Q和N437A完全丧失ATP响应能力,证明变构路径的完整性对功能至关重要。有趣的是,催化残基E434的突变(E434A)反而增强ATP/FAD结合稳定性,提示催化循环与辅因子结合存在动态平衡。
这项研究首次阐明ATP能作为变构激活剂调控氧化还原酶活性,突破了"ATP仅调控核苷酸代谢酶"的传统认知。发现的螺旋束移位机制为设计变构药物提供了新思路。在应用层面,该发现为理解线虫信息素合成的环境响应机制,以及人类ACOX1相关代谢疾病(如肝性脑病)的治疗策略开发提供了理论基础。特别值得注意的是,ATP结合位点在多种 nematode ACOX同源蛋白中高度保守,暗示这可能是能量感知的古老调控模式。
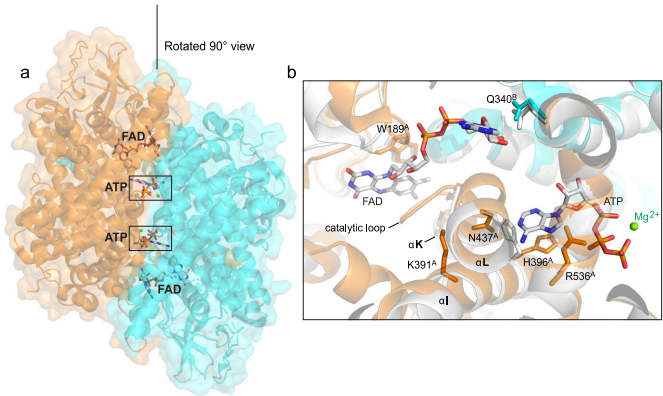
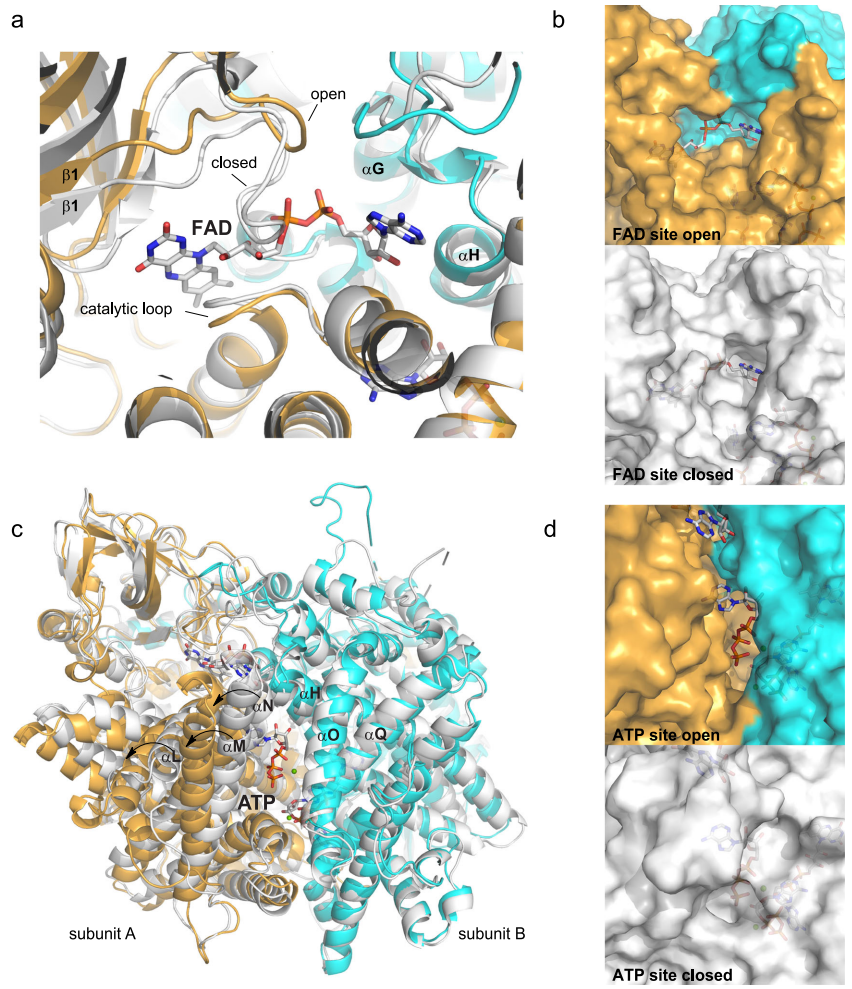
研究还留下若干待解问题:细胞内ATP浓度波动如何动态调节ACOX活性?其他物种的ACOX是否具有类似调控机制?这些问题的解答将进一步完善我们对能量代谢网络的理解。
 生物通微信公众号
生物通微信公众号
知名企业招聘