
-

生物通官微
陪你抓住生命科技
跳动的脉搏
PABPC1 SUMO化通过稳定应激颗粒中富含U的mRNA促进线粒体自噬增强细胞存活
【字体: 大 中 小 】 时间:2025年08月09日 来源:Nature Communications 15.7
编辑推荐:
本研究揭示了应激颗粒(SGs)核心组分PABPC1在应激条件下发生SUMO化修饰的分子机制,发现K512位点SUMO化通过形成PABPC1-SUMO-TIA1复合体选择性稳定富含U序列的mRNA(如FUNDC1、BNIP3L等线粒体自噬相关基因),促进应激颗粒组装并增强肿瘤细胞在应激环境下的存活能力,为肿瘤耐药机制提供了新靶点。
在肿瘤微环境中,细胞持续面临氧化应激、营养匮乏等多种压力,应激颗粒(Stress granules, SGs)作为无膜细胞器通过调控mRNA代谢帮助细胞适应应激。然而,SGs如何选择性稳定特定mRNA亚群、其核心组分翻译后修饰的调控机制及其与细胞存活途径的关联,始终是领域内亟待解决的关键科学问题。
上海交通大学医学院的研究团队在《Nature Communications》发表的研究,首次揭示了多聚腺苷酸结合蛋白PABPC1的SUMO化修饰通过稳定线粒体自噬相关mRNA促进肿瘤细胞存活的分子机制。研究采用CRISPR/Cas9基因编辑构建敲除细胞系,结合4-硫尿苷脉冲追踪测序(4sU-Seq)和RNA免疫共沉淀测序(RIP-Seq)技术,发现应激诱导的PABPC1 K512位点SUMO化显著增强其与U-rich mRNA的结合能力。通过免疫共沉淀-质谱联用技术(Co-IP/MS)和荧光漂白恢复实验(FRAP),证实SUMO化PABPC1通过与TIA1蛋白的SUMO相互作用模体(SIM)结合,形成三元复合体将U-rich mRNA招募至SGs中保护其免于降解。
研究结果部分:
PABPC1 SUMO化受多种应激动态调控:通过Ni2+-NTA pull down和变性免疫沉淀证实,氧化应激(砷酸盐处理)、热休克等均可诱导PABPC1 K512位点SUMO1修饰,该修饰可被去SUMO化酶SENP1逆转。
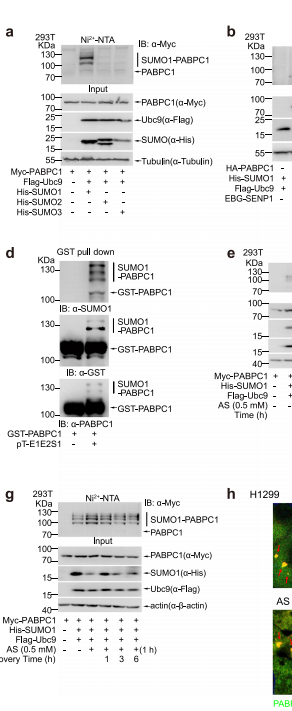
K512是主要SUMO化位点:质谱分析和位点突变实验显示,K512R突变使120 kDa特征条带消失,且该位点位于PABPC1 linker区,可能影响相分离功能。
SUMO化促进应激颗粒形成:免疫荧光显示SENP1敲除细胞SG形成增强,而PABPC1 K512R突变体转染细胞SG组装能力显著减弱,但不影响解聚过程。
mRNA稳定性调控机制:4sU-Seq发现应激条件下PABPC1-WT细胞中U-rich mRNA半衰期延长2倍,特别是线粒体自噬相关基因FUNDC1、BNIP3L等。
PABPC1-SUMO-TIA1复合体形成:SUMO化增强PABPC1与TIA1结合,后者通过识别U-rich元件选择性招募靶mRNA至SGs。体外实验证实该复合体可直接结合poly(U)RNA。
促存活功能验证:K512R突变使细胞在砷酸盐处理下存活率降低40%,过表达FUNDC1可挽救表型;mtKeima线粒体自噬检测显示SUMO化缺陷细胞自噬流下降50%。
这项研究建立了SUMO化修饰-RNA代谢-细胞应激适应的全新调控轴:①阐明SUMO化作为SGs动态组装的关键开关;②揭示PABPC1通过"SUMO-SIM"相互作用实现mRNA选择性稳定的分子密码;③首次将SGs功能与线粒体质量控制直接关联,为靶向肿瘤应激适应通路提供新策略。研究发现的PABPC1-TIA1-U-rich mRNA调控模块,可能普遍存在于神经退行性疾病等病理过程中,具有广泛生物学意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘