
-

生物通官微
陪你抓住生命科技
跳动的脉搏
人源化髓系重建NSG-SGM3与MISTRG小鼠模型的创新突破及先天免疫研究挑战
【字体: 大 中 小 】 时间:2025年08月09日 来源:TRENDS IN Immunology 13.9
编辑推荐:
本文聚焦人源化小鼠模型在先天免疫研究中的瓶颈问题,通过比较NSG-SGM3(表达人SCF/GM-CSF/IL-3)与MISTRG(人源化M-CSF/IL-3/GM-CSF/TPO/Sirpα)两种髓系重建模型,系统分析了其在感染、肿瘤等研究中面临的MAS(巨噬细胞活化综合征)、血小板缺陷等挑战,并提出引入KITW41突变、HLA-A2转基因等改进策略,为人类特异性免疫应答研究提供新工具。
在免疫学研究领域,人类与小鼠的物种差异长期阻碍着先天免疫机制的转化研究。传统人源化小鼠模型虽能重建人类适应性免疫系统,但髓系细胞(如巨噬细胞、中性粒细胞)的植入效率低下,导致对感染、肿瘤等人类特异性免疫应答的模拟存在重大缺陷。这一瓶颈催生了NSG-SGM3和MISTRG两种革命性模型——它们通过转基因表达人类髓系生长因子,首次实现了高效的人类髓系细胞重建,为先天免疫研究开辟了新途径。
比利时根特大学炎症研究中心(VIB-UGent Center for Inflammation Research)的Hannah Stocks和Andy Wullaert团队在《TRENDS in Immunology》发表综述,系统剖析了这两种模型的优势与局限。研究人员采用跨物种比较分析策略,结合基因编辑(如KITW41突变)、多因子转基因(如NSG-QUAD添加M-CSF)和免疫系统人源化(如HLA-A2移植)等技术,揭示了当前模型在血小板缺陷、巨噬细胞过度活化等关键问题上的突破方向。
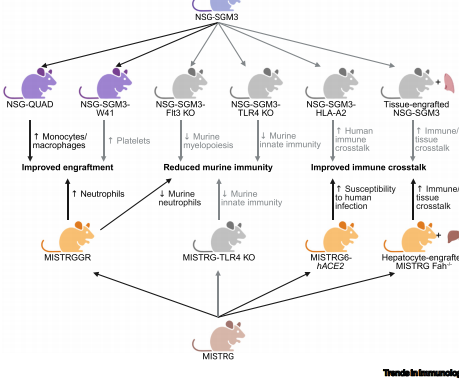
NSG-SGM3通过转基因过表达人SCF(干细胞因子)、GM-CSF(粒细胞-巨噬细胞集落刺激因子)和IL-3(白细胞介素-3),而MISTRG则在BRG背景上直接人源化M-CSF、IL-3等基因的编码区。最新衍生的NSG-SGM3-W41模型通过cKIT受体突变联合17β-雌二醇补充,实现了无预处理的造血干细胞植入和淋巴组织发育。
血小板缺陷修正:KITW41突变显著改善血小板生成,这对登革热病毒(DENV)等依赖血小板病理机制的感染研究至关重要。
单细胞亚群重建:NSG-QUAD模型新增M-CSF表达后,可重建CD14+CD16-、CD14+CD16+和CD14-CD16+三类单核细胞亚群,并诱发强炎症反应。
免疫协同障碍:通过共移植人胸腺组织或替换MHC基因(如NSG-A2中的HLA-A2),可改善T细胞与抗原呈递细胞的协作,使埃博拉病毒(EBOV)感染模型更贴近临床病程。
巨噬细胞活化综合征(MAS)是NSG-SGM3的主要副作用,表现为IL-6介导的过度炎症。研究人员提出通过Toll样受体4(TLR4)敲除或人源化IL-6基因(如MISTRG6-HACE2)来调控该现象。
这项研究的意义在于:首次系统评估了髓系重建模型的免疫缺陷补偿机制,提出的KITW41-HLA-A2联合优化策略,为建立登革热、埃博拉等人类特异性感染模型提供了标准化框架。未来,整合肝脏人源化(如MISTRG Fah-/-)或中性粒细胞特异性因子(如MISTRGGR的G-CSF人源化)的下一代模型,将推动感染免疫学和肿瘤免疫治疗的突破性进展。
 生物通微信公众号
生物通微信公众号
知名企业招聘