
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:寄生虫基因组组织:现在就开始聚集吧!
【字体: 大 中 小 】 时间:2025年08月09日 来源:TRENDS IN Parasitology 6.6
编辑推荐:
这篇综述深入探讨了锥虫(Trypanosoma)和疟原虫(Plasmodium)通过独特的基因组三维结构调控抗原变异(如VSG和var基因)和转录程序的机制。文章揭示了核区室(如ESB)、生物分子凝聚体(如VEX2)和长程DNA互作(如AP2-P/MORC介导的var基因簇)在免疫逃逸和生命周期转换中的关键作用,为理解寄生虫病原性提供了新视角。
寄生虫的混乱生活方式:多顺反子转录与反式剪接共存
锥虫(如布氏锥虫Trypanosoma brucei)的基因以多顺反子转录单元(PTUs)形式排列,数百个功能无关的基因被RNA聚合酶II(RNAPII)整体转录为多顺反子前体mRNA,再通过反式剪接添加39核苷酸的剪接前导RNA(SL-RNA)形成成熟mRNA。这种罕见的转录模式与哺乳动物截然不同——锥虫缺乏典型的转录因子,主要依赖RNA加工速率和稳定性调控基因表达。
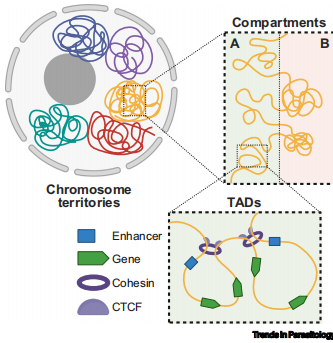
基因组分为核心区(保守)和破坏区(含表面糖蛋白多基因家族)。破坏区在布氏锥虫中位于亚端粒,而在克氏锥虫(T. cruzi)中广泛分布,两者均形成类似哺乳动物A/B区室的结构。破坏区的高密度结构可能通过重组或差异转录促进抗原多样性,帮助锥虫适应胞内外环境。
疟原虫的复杂转录程序:阶段特异性调控网络
恶性疟原虫(Plasmodium falciparum)采用单顺反子转录,其生命周期各阶段由特定的ApiAP2转录因子驱动。尽管缺乏典型增强子,疟原虫通过核糖体DNA(rDNA)、端粒和着丝粒的簇状分布构建基因组框架。独特的var基因簇通过长程互作实现表观沉默,这对建立感染至关重要。
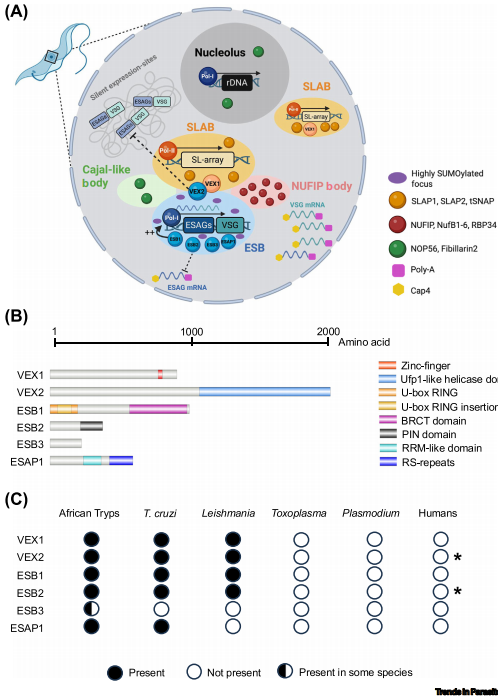
锥虫的核区室:为VSG基因打造高效生产线
布氏锥虫通过表达位点体(ESB)专一性转录单个VSG基因,其他VSG表达位点(VSG ESs)则被沉默并空间隔离。ESB特异性蛋白ESB1(转录激活因子)和VEX2(RNA解旋酶)分别调控活性VSG的转录和沉默位点的排斥。VEX2形成的生物分子凝聚体通过连接活性VSG基因与SL-array(反式剪接关键元件),确保单个VSG的高效表达和等位基因排斥。
疟原虫的var基因簇:表观沉默与遗传重组双管齐下
恶性疟原虫的var基因通过HP1介导的异染色质化(H3K9me3标记)沉默,而活性var基因则富集组蛋白乙酰化。Micro-C技术揭示,亚端粒非编码区通过折叠结构使var基因线性排列,其锚定点由AP2-P、MORC和TRZ蛋白结合,促进端粒间互作。这种空间排列可能为var基因重组创造有利条件,扩大抗原库多样性。
RNAPI工厂:核仁中的rDNA协同激活
所有rDNA位点定位于核仁,但仅活跃位点直接互作。恶性疟原虫的HMGB1蛋白特异性结合活跃rDNA,可能驱动其阶段特异性激活。类似地,锥虫的RNAPIII转录tRNA基因也形成空间簇。
RNAPII枢纽:阶段特异性基因的爆发式转录
锥虫的RNAPII转录起始位点(TSSs)形成独立区室,显微镜下呈“转录枢纽”结构。疟原虫的活跃基因(如孢子体期特异性基因)通过长程互作形成空间簇,可能由AP2-I和PfMORC等因子介导。PfMORC的Kelch重复结构域(其他物种中未见)可能通过蛋白互作搭建基因组骨架,替代哺乳动物中CTCF的功能。
单细胞Hi-C和超分辨显微技术(如ChromExM)将揭示寄生虫群体异质性和核区室动态。生物分子凝聚体(如VEX2)的相分离机制、var基因切换的空间调控等仍是关键问题。这些研究将深化对寄生虫免疫逃逸和宿主适应的理解,为抗寄生虫药物开发提供新靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘