
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:NK细胞来源外泌体在抗肿瘤策略中的应用
【字体: 大 中 小 】 时间:2025年08月10日 来源:Medical Oncology 3.5
编辑推荐:
(编辑推荐)本综述系统阐述了NK细胞来源外泌体(NK-Exos)在肿瘤治疗中的多重机制与应用前景。这些纳米级囊泡携带穿孔素(PFN)、颗粒酶(Gzm)等细胞毒性分子,通过死亡受体配体(如FasL)介导凋亡,并能递送化疗药物(如顺铂)、siRNA(如BCL-2靶向序列)及诱导铁死亡(如RSL3)。工程化改造(如CAR修饰、IL-15 priming)可增强其靶向性和穿透血脑屏障(BBB)能力,为克服肿瘤微环境(TME)免疫抑制提供新策略。
作为先天免疫淋巴细胞的重要亚群,自然杀伤细胞(NK)具有独特的抗肿瘤特性。其分泌的外泌体(NK-Exos)直径约50-150 nm,保留母细胞表面标志物如DNAM-1和NKG2D,并携带穿孔素、颗粒酶A/B(GzmA/B)等效应分子。通过差速超速离心或尺寸排阻色谱法分离的NK-Exos,经透射电镜(TEM)可观察到典型的杯状结构,而纳米颗粒追踪分析(NTA)能确认其粒径分布。
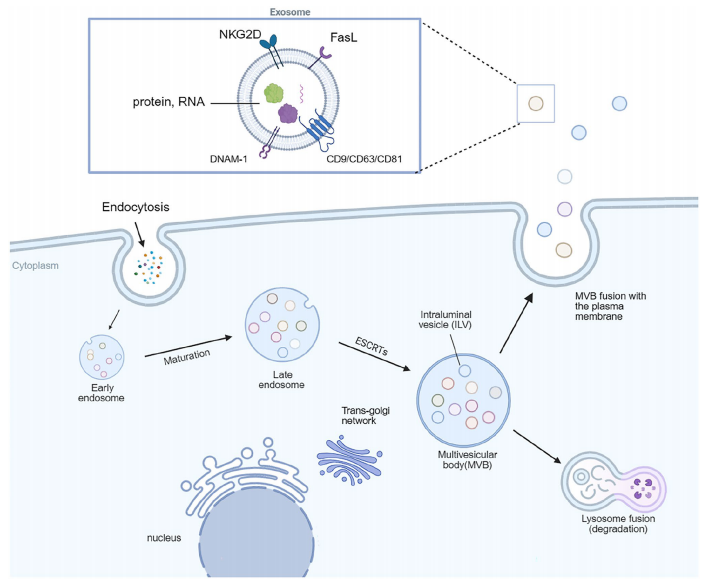
这些纳米囊泡通过多途径杀伤肿瘤:
细胞毒性分子释放:穿孔素在靶细胞膜形成孔道,使颗粒酶B(GzmB)进入胞质激活caspase-3/7,而颗粒酶A(GzmA)通过切割SET复合物诱发DNA损伤。
死亡受体通路:表面FasL与肿瘤细胞Fas受体结合,募集FADD形成死亡诱导信号复合体(DISC),激活caspase-8/10级联反应。
免疫调节:携带的miR-186可阻断TGF-β信号,而miR-30e-3p通过抑制CDK6阻滞食管癌(ESCC)细胞周期。
为提高靶向性,研究者开发了多种策略:
药物装载:超声法将奥沙利铂(L-OHP)封装后,对结直肠癌的细胞毒性显著增强;光敏剂氯e6(Ce6)与ROS敏感连接器TK结合,实现激光触发药物释放。
表面修饰:T7肽修饰增强血脑屏障穿透,而CAR结构使外泌体特异性识别HER2+肿瘤。
基因调控:载有siBCL-2的NK-Exos选择性诱导乳腺癌细胞凋亡,而miR-5193联合卡铂可抑制STAT3/PD-L1轴。
NK-Exos与PD-1抑制剂联用可逆转T细胞耗竭,而RSL3诱导的铁死亡与FASL细胞毒作用产生协同效应。但异质性分离效率(目前仅30-50%)、体内快速清除等问题仍需解决。最新研究通过锰配位纳米簇(AMNCs)下调FTO/GPX4轴,为口腔鳞癌(OSCC)提供了新型铁死亡治疗方案。
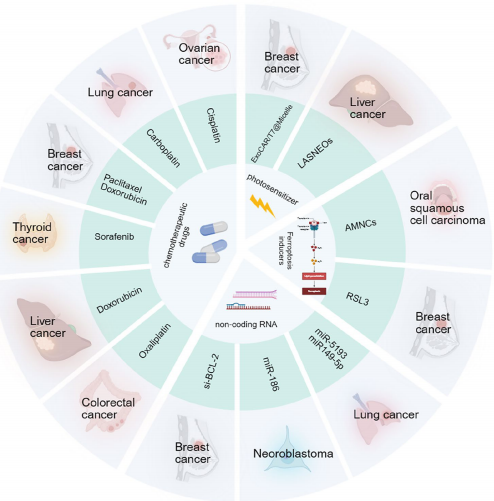
未来方向包括建立标准化生产流程、探索外泌体与TME动态互作,以及开发多功能杂交囊泡(如融合脂质体的hNRV)。这些进展将推动NK-Exos从实验室向临床转化,为实体瘤治疗提供突破性策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘