
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脊椎动物RNA中发现与钙信号和神经肌肉功能相关的胍核糖开关
【字体: 大 中 小 】 时间:2025年08月10日 来源:Nature Communications 15.7
编辑推荐:
研究人员通过生物信息学分析和生化验证,在脊椎动物RNA中发现与细菌同源的胍核糖开关(guanidine-I和guanidine-II),这些开关调控与Ca2+转运/信号传导及神经肌肉功能相关的基因。实验证实人类CA8蛋白可增加细菌细胞内胍浓度,揭示了胍作为天然信号分子在神经肌肉疾病治疗中的潜在机制,为拓展真核生物核糖开关的认知提供关键证据。
在生物医学领域,胍(guanidine)作为蛋白质变性剂长期被用于工业生产和临床治疗,但其在生物体内的天然功能一直成谜。1876年就有研究报道胍能增强肌肉收缩,后来被用于治疗Lambert-Eaton肌无力综合征等神经肌肉疾病,然而其作用机制始终未明。近年来,细菌中发现的四类胍核糖开关(guanidine-I至IV)揭示了胍作为广泛存在的天然代谢物的身份,但动物是否天然利用胍仍缺乏证据。这一科学谜题吸引了耶鲁大学(Yale University)Ronald R. Breaker团队的目光,他们通过系统性研究首次在脊椎动物中发现了功能性的胍核糖开关,相关成果发表在《Nature Communications》上。
研究人员采用生物信息学筛选结合体外生化验证的技术路线:首先通过Infernal算法扫描脊椎动物基因组,寻找与细菌胍核糖开关相似的RNA结构;随后通过体外线探针分析(in-line probing)验证候选RNA的胍结合能力;最后利用Bacillus subtilis报告系统(含lacZ基因与细菌guanidine-I核糖开关融合)检测人类CA8蛋白对胍代谢的影响。
研究结果部分:
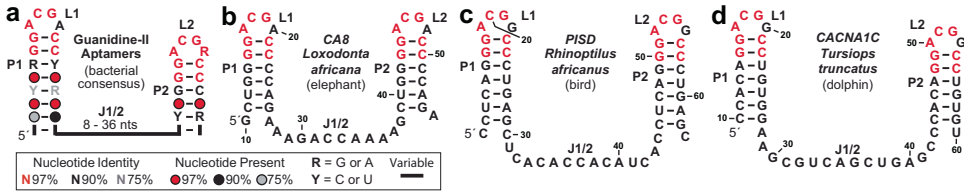
Guanidine-II核糖开关适配体在脊椎动物中的发现
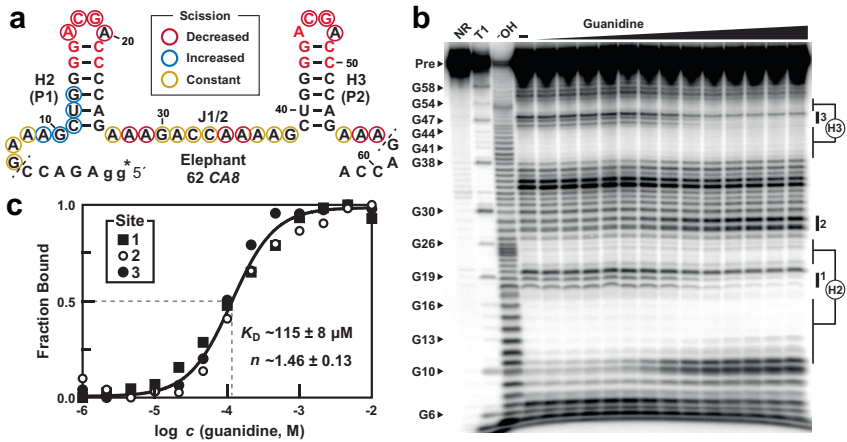
在非洲象CA8基因内含子区域发现9个串联排列的hairpin结构,其中两个(H2-H3)经62 CA8 RNA构建体验证可协同结合两分子胍(KD=111±3 μM),结合特性与细菌同源物一致。112 CA8构建体(含H4-H7)则展现出更复杂的多价结合模式,提示脊椎动物可能进化出更精细的胍传感机制。
人类CA8蛋白调控胍代谢
在B. subtilis模型中,表达野生型CA8可使报告基因活性提升50倍,而致病突变体Y218C(导致脊髓小脑共济失调)无此效应,首次证明脊椎动物蛋白直接参与胍代谢调控。
胍-I型适配体与钙信号基因的关联
在ITPR1(肌醇1,4,5-三磷酸受体)、CACNA1C(电压门控钙通道)等89个基因中发现胍-I型适配体候选,这些基因均与Ca2+稳态或神经肌肉疾病相关。例如ITPR1与CA8蛋白互作,两者突变均导致脊髓小脑共济失调,暗示胍-Ca2+信号轴的存在。
讨论指出,该研究不仅证实脊椎动物天然利用胍作为信号分子,还建立了胍核糖开关-Ca2+信号-神经肌肉疾病的分子关联。CA8可能通过催化胍或其衍生物(如羧基胍)的代谢参与这一过程,为理解胍的临床疗效提供机制解释。更深远的意义在于,这是继TPP核糖开关后,真核生物中验证的第二类代谢物感应RNA元件,打破了"核糖开关主要存在于原核生物"的传统认知,为RNA调控网络的进化研究开辟了新方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘