
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:CRISPR/Cas技术在胰腺癌研究与治疗中的应用:最新进展与未来展望
【字体: 大 中 小 】 时间:2025年08月13日 来源:Discover Oncology 2.9
编辑推荐:
这篇综述系统阐述了CRISPR/Cas技术在胰腺癌研究中的革命性应用,涵盖基因编辑(KRASG12D等突变靶向)、肿瘤模型构建(GEMMs/PDX/类器官)及治疗策略开发(如CAR-T联合免疫治疗)。特别强调了该技术在克服化疗耐药(如gemcitabine)、调控肿瘤微环境(TME)及发现新靶点(如USP15/SCAF1)方面的突破性进展,为精准医疗提供新范式。
胰腺导管腺癌(PDAC)作为恶性程度最高的肿瘤之一,其五年生存率不足10%。KRAS、TP53等基因突变与EGFR、Notch等信号通路异常构成其分子特征,而高度免疫抑制的肿瘤微环境(TME)则导致传统治疗(手术/化疗/放疗)效果有限。CRISPR/Cas系统凭借其精准的基因编辑能力,正在重塑胰腺癌研究格局。
源自细菌免疫防御机制的CRISPR/Cas9通过sgRNA引导核酸酶靶向切割DNA,依赖PAM序列(如NGG)确保特异性。双链断裂(DSB)后,细胞通过易错的NHEJ或精确的HDR进行修复——前者用于基因敲除(如KRASG12D),后者适用于基因校正。衍生技术dCas9通过融合转录抑制域(KRAB)或激活域(VP64)实现基因沉默(CRISPRi)或激活(CRISPRa),而Cas13/CasRx则专攻RNA编辑。新型碱基编辑器(CBE/ABE)和Prime编辑器(PE)进一步实现了无DSB的单碱基修改。
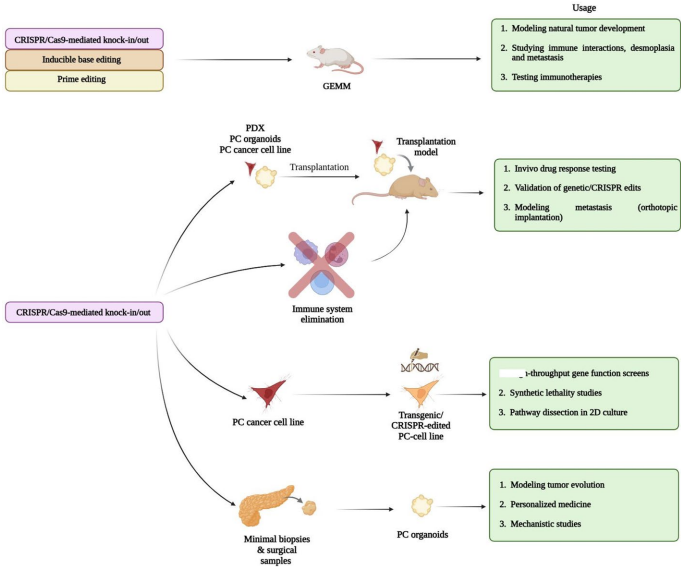
CRISPR技术极大简化了基因工程小鼠模型(GEMMs)的创建。通过Pdx1-Cre与LSL-KRASG12D系统结合CRISPR敲除Lkb1,可加速胰腺肿瘤发生。更复杂的多基因编辑(如KRASG12D+TP53-/-+SMAD4-/-)则通过AAV递送实现。类器官模型通过CRISPR敲入KRAS突变并联合CDKN2A等抑癌基因缺失,成功模拟了人类PDAC的异质性。值得注意的是,CRISPR介导的染色体大片段重组(CRISMERE)为研究基因组结构变异提供了新工具。
全基因组CRISPR筛选揭示了多个胰腺癌关键依赖基因:
化疗耐药相关:PSMA6缺失增强gemcitabine敏感性,CDK7敲除可逆转紫杉醇耐药
代谢调控:ISG15缺失破坏肿瘤干细胞代谢可塑性,PCK1敲除抑制糖异生
免疫逃逸:RIPK2敲除增强PD-1疗效,TFAP4缺失恢复CAR-T细胞杀伤效率
表观遗传:KDM3A敲除促进T细胞浸润,Ring1b缺失阻止腺泡细胞去分化
致癌基因编辑:CasRx特异性沉默KRASG12D mRNA抑制肿瘤生长,而Prime编辑器可同时校正12种KRAS突变变体
克服耐药:BRCA1/2基因修复恢复Olaparib敏感性,MUC4敲除逆转gemcitabine耐药
免疫调控:CD40L武装的溶瘤病毒重塑TME,ISG15缺失降低PD-L1表达
非编码区干预:miR-3064敲除抑制转移,HOXA-AS3 CRISPRi阻断miR-29c/CDK6轴
当前限制包括p53介导的编辑细胞负向选择、AAV载体容量限制及Cas9免疫原性。未来方向聚焦于:
新型递送系统(如外泌体装载RNP)
高保真编辑器开发(如PE4/PE5)
联合治疗策略(免疫检查点抑制剂+CRISPR-edited CAR-T)
临床转化推进(NCT05795595等试验)

 生物通微信公众号
生物通微信公众号
知名企业招聘