
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CAR-T治疗后克隆性扩增的淋巴结T细胞群体被诊断为T细胞淋巴瘤:单细胞空间转录组揭示TFH样肿瘤行为
【字体: 大 中 小 】 时间:2025年08月13日 来源:Nature Communications 15.7
编辑推荐:
本研究报道一例弥漫大B细胞淋巴瘤(DLBCL)患者在CAR-T治疗后2.5年出现新发淋巴结病,经深度分子检测发现其具有T滤泡辅助细胞(TFH)转录特征的双阳性(CD4+CD8+)克隆性T细胞群体。通过全基因组测序(WGS)和5'端单核空间转录组(Slide-tags)技术,证实该群体无CAR构建体整合但存在TET2突变,其自发消退现象挑战了传统T细胞淋巴瘤(TCL)诊断标准,为CAR-T后淋巴增殖性疾病的鉴别提供新见解。
在癌症免疫治疗领域,CAR-T细胞疗法为B细胞恶性肿瘤患者带来了革命性突破,但伴随而来的安全性问题日益凸显。2023年FDA发布关于CAR-T衍生T细胞恶性肿瘤风险的警告,将这一潜在并发症推至研究前沿。尽管继发恶性肿瘤总体发生率较低(3-16%),但其中T细胞淋巴瘤(TCL)的病例尤为特殊——它们可能源于CAR构建体的插入突变,也可能是治疗相关免疫失调的产物。更复杂的是,在COVID-19大流行背景下,病毒感染与CAR-T治疗后异常免疫反应间的相互作用机制仍属未知领域。
Dana-Farber癌症研究所的研究团队在《Nature Communications》发表了一项突破性研究。他们发现一例接受axi-cel治疗的DLBCL患者,在COVID-19感染期间出现高度FDG摄取的颈部淋巴结肿大。常规病理检查显示CD4+CD8+双阳性T细胞群体表达TFH标志物(BCL-6、PD-1等),符合TCL诊断标准。但令人惊讶的是,这个Ki-67达40-50%的克隆性群体在6周后自发消退。为破解这一矛盾现象,研究者采用三大关键技术:全基因组测序排除了CAR转基因整合(检测灵敏度达3.4%细胞频率);5'端单核空间转录组(Slide-tags)技术首次实现TCR可变区捕获与空间定位;以及T细胞功能程序量化算法(TCAT)解析转录特征。
临床病例特征
该80岁男性患者具有9年滤泡性淋巴瘤(FL)病史,经多线治疗(包括R-CHOP方案)后接受axi-cel治疗。2.5年无复发期间突发COVID-19感染,伴随新发淋巴结病。活检显示异常T细胞共表达CD4/CD8和TFH标记,但缺乏EBV感染证据。
基因组特征
WGS检测到TET2 p.W776fs*4移码突变(等位基因频率67%),但未发现CAR转基因序列。TCR测序揭示双等位基因重排现象,产生两条α链(CASPGLTGGGNKLTF和CALSHPFRNSGNTPLVF)和两条β链(CASSLVVWRGLRN EQFF和CASSQQDSRNTIYF)。
空间转录组解析
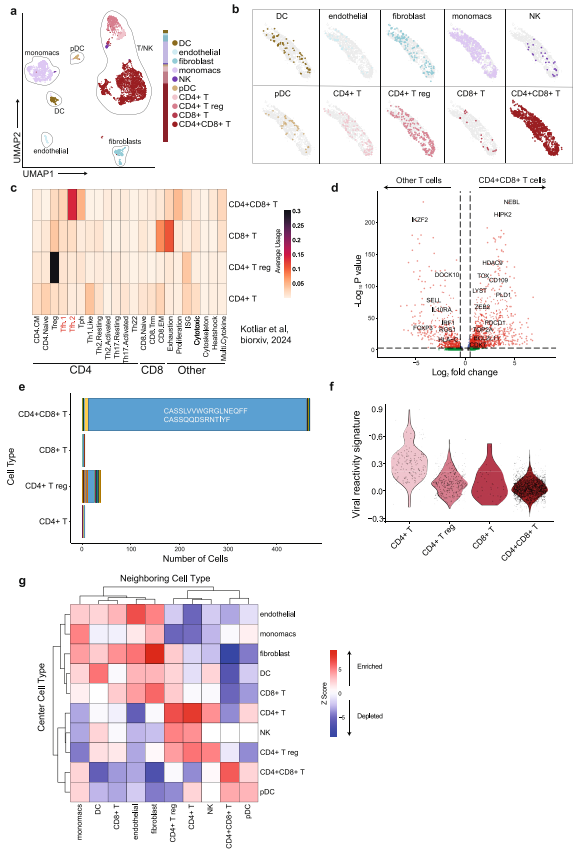
双阳性T细胞占淋巴结细胞的51%,其转录谱显示:
高表达TFH程序基因(CXCL13、IL21等)
富集缺氧/应激反应通路(HIF1A、JUNB)
缺乏病毒反应特征(与COVID-19无关)
空间分析揭示这些细胞形成免疫排斥微环境,周围显著缺乏树突状细胞(DC)和调节性T细胞(Treg)。
讨论与意义
这项研究提出了三个关键创新点:首先,定义了CAR-T后新型淋巴增殖性疾病实体——具有恶性表型但可能自发消退的克隆性TFH样T细胞群体;其次,开发了5'端Slide-tags技术解决TCR空间分析难题;最后,揭示TET2突变可能通过表观遗传调控驱动异常增殖。临床层面,该案例警示在感染背景下需谨慎解读CAR-T后T细胞克隆性增殖现象,避免过度治疗。未来需建立更精准的诊断标准来区分真正恶性TCL与一过性淋巴增殖反应,这对保障CAR-T疗法的合理应用至关重要。
 生物通微信公众号
生物通微信公众号
知名企业招聘