
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脂质相互作用与门控滞后揭示细菌机械敏感通道YnaI的生理功能机制
【字体: 大 中 小 】 时间:2025年08月13日 来源:Nature Communications 15.7
编辑推荐:
本研究针对细菌机械敏感通道YnaI的激活机制不明问题,通过冷冻电镜、分子动力学模拟和膜片钳电生理技术,揭示了其与MscS不同的脂质相互作用模式及显著的滞后门控特性。研究发现YnaI的额外跨膜螺旋使脂质填充疏水口袋远离膜双层,导致其需接近膜裂解张力才能激活,但开放后可维持更长时间以促进渗透压平衡。该成果为理解细菌应对渗透压变化的多元策略提供了新视角。
在细菌应对环境渗透压变化的防御系统中,机械敏感通道(Mechanosensitive channels, MSCs)扮演着关键角色。其中小电导机械敏感通道(MscS)家族成员YnaI因具有两个额外跨膜螺旋而结构独特,但其激活机制与生理功能长期存在争议。传统认知认为MscS通过"脂质先动"机制(lipids-move-first)响应膜张力变化,而YnaI是否遵循相同机制尚不明确。更令人困惑的是,YnaI虽与MscL类似需接近膜裂解张力才能激活,但其仅产生0.1 nS的小电导,这种看似矛盾的特性暗示其可能具有未被发现的特殊生理功能。
为解开这些谜团,来自洛克菲勒大学等机构的研究团队在《Nature Communications》发表了突破性研究成果。研究人员采用冷冻电镜(cryo-EM)解析了纳米盘嵌入的YnaI闭合态结构,发现其疏水口袋中的脂质比MscS更稳定且远离膜双层。通过分子动力学(MD)模拟证实,额外跨膜螺旋TM-N1和TM-N2将YnaI核心结构推离膜平面约4.2?,使口袋脂质与膜间距增加3?。这种独特的结构特征解释了为何YnaI需要更高膜张力激活——脂质从更深的口袋中抽离需要更大能量。
研究采用多项关键技术:1)冷冻电镜解析YnaI在不同脂质环境下的高分辨率结构;2)分子动力学模拟比较YnaI与MscS的脂质相互作用差异;3)膜片钳记录分析突变体在巨大原生质球中的电生理特性;4)β-环糊精(βCD)和溶血磷脂酰胆碱(LPC)处理模拟膜张力变化。
研究结果部分的重要发现包括:
"闭合静息态的YnaI结构"显示,与MscS相比,YnaI的孔隙半径更小(
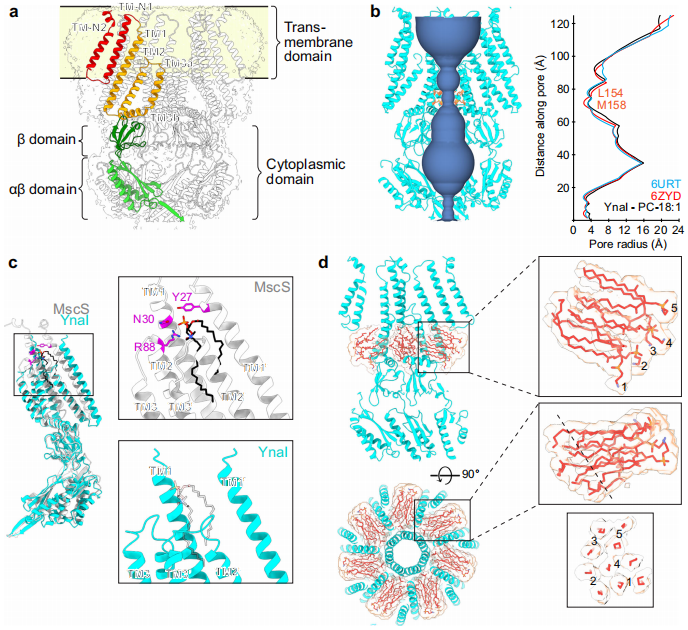
"纳米盘无法获得YnaI开放态结构"部分发现,βCD虽能在脂质体中激活YnaI,但纳米盘中的YnaI仍保持闭合态,暗示纳米盘环境可能限制构象变化。
"YnaI口袋脂质不与膜自由交换"通过分子动力学模拟揭示,YnaI口袋脂质填充速度比MscS慢4倍(
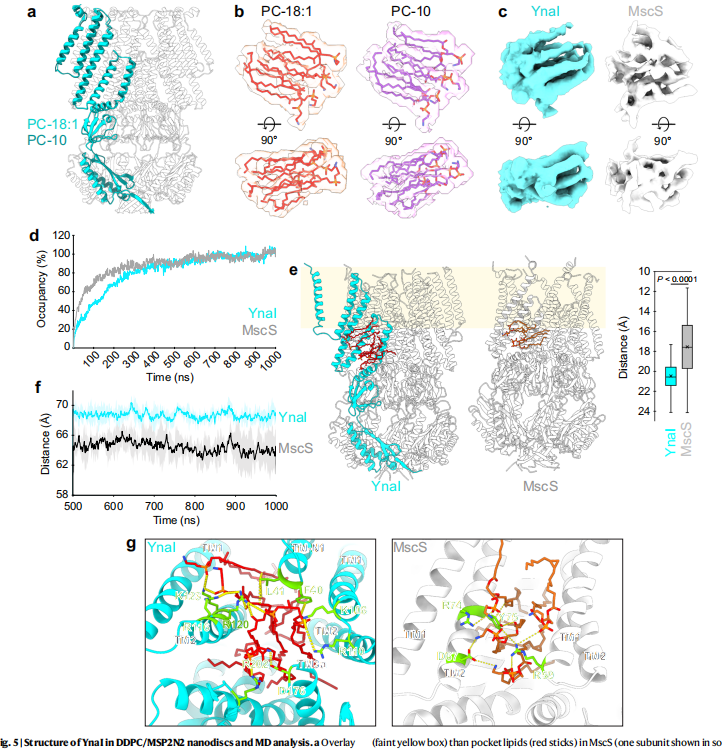
"YnaI与MscS的通道特性差异"部分通过膜片钳实验首次量化了YnaI的显著门控滞后现象:开放阈值(146.7±7.7 mmHg)接近MscL,但关闭阈值(-67.3±5.2 mmHg)显著降低,使其能在更低膜张力下保持开放(

研究结论创新性地提出YnaI的生理功能分工模型:在快速渗透压变化时,MscS和MscL主导响应;而在慢速变化时,YnaI凭借其滞后特性可替代已失活的MscS,将膜张力持续降至安全水平(约4.8 mN/m)。定量分析显示,30个YnaI通道可在1.3秒内释放5×108个离子,协同其他通道共同维持渗透平衡。该研究不仅阐明了细菌机械敏感通道的功能多样性,也为理解真核生物机械敏感通道的进化起源提供了新线索。
 生物通微信公众号
生物通微信公众号
知名企业招聘