
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:PARP抑制剂在实体瘤中的血液学毒性:系统评价与安全性荟萃分析
【字体: 大 中 小 】 时间:2025年08月15日 来源:Cancer and Metastasis Reviews 8.7
编辑推荐:
这篇综述系统评价了PARP抑制剂(PARPis)在实体瘤治疗中引发的血液学毒性(AEs),通过31项随机对照试验(RCTs)证实PARPis显著增加贫血(49.2%)、中性粒细胞减少(32.3%)和血小板减少(30.1%)风险,≥3级毒性风险更高(RR=5.43-5.42)。研究强调临床需警惕卵巢/乳腺癌患者的高风险,但未增加AML/MDS发生率。
聚腺苷二磷酸核糖聚合酶(PARP)抑制剂(PARPis)作为靶向DNA损伤修复(DDR)通路的重要药物,已在卵巢癌、乳腺癌等多种实体瘤中展现疗效。然而其独特的血液学毒性谱成为临床管理的关键挑战。最新荟萃分析揭示,PARPis导致近半数患者出现贫血,且严重血液学不良事件(≥G3)风险激增5倍以上。
采用PRISMA指南对截至2024年4月的31项II/III期RCTs(共11,708例患者)进行系统评价。通过风险比(RR)量化PARPis(奥拉帕利、尼拉帕利等)对比非PARPis治疗的毒性差异,亚组分析涵盖药物类型、肿瘤种类和治疗方案。所有数据经GRADE评估确认为高质量证据。
贫血占据毒性事件首位,全级别发生率达49.2%,其中≥G3占25.0%。PARPis组贫血风险较对照组翻倍(RR=2.15),严重贫血风险激增5.43倍。中性粒细胞减少(RR=1.50)和血小板减少(RR=2.59)同样显著,且≥G3事件分别增加1.7倍和5.42倍。值得注意的是,不同PARPis毒性谱差异显著:尼拉帕利引发血小板减少风险最高(RR=17.6),而奥拉帕利相对温和。
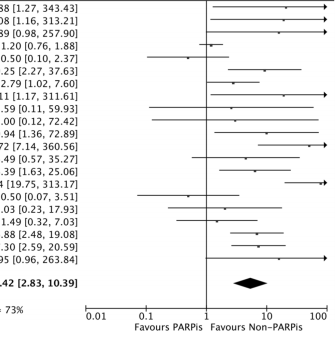
卵巢癌患者面临最高≥G3贫血风险(RR=12.46),前列腺癌则更易出现血小板减少(RR=4.66)。联合治疗方案中,PARPi+抗血管生成药组贫血风险骤升46倍,而PARPi单药治疗时血液学毒性相对可控。治疗时长≤12个月的患者毒性风险显著低于长期用药组。
PARP-2抑制被证实与红细胞分化障碍直接相关,而血小板减少源于对巨核细胞成熟的可逆抑制。指南建议血红蛋白<8 g/dL时暂停给药,血小板<50×109/L需剂量调整。TALAPRO-2研究显示,他拉唑帕利组13.1%患者需输血支持,提示积极监测的必要性。
令人欣慰的是,AML/骨髓增生异常综合征(MDS)发生率与对照组无统计学差异(p=0.86)。但研究者强调,持续4周以上的严重血细胞减少需进行骨髓评估以排除继发血液系统恶性肿瘤。
 生物通微信公众号
生物通微信公众号
知名企业招聘