
-

生物通官微
陪你抓住生命科技
跳动的脉搏
UBE2C通过泛素化降解ACSL4抑制铁死亡促进胃癌进展的机制研究
【字体: 大 中 小 】 时间:2025年08月16日 来源:Discover Oncology 2.9
编辑推荐:
本研究针对胃癌预后差、复发率高的临床难题,揭示了UBE2C通过K48连接的多聚泛素化修饰促进ACSL4蛋白降解,进而抑制铁死亡(ferroptosis)促进胃癌进展的新机制。研究人员通过TCGA/GEO数据库分析发现UBE2C在胃癌中显著高表达,通过体内外实验证实UBE2C-ACSL4调控轴可影响Fe2+积累和ROS生成,GSH干预实验进一步验证该通路可作为胃癌治疗新靶点,为开发靶向铁死亡的抗癌策略提供了理论依据。
胃癌作为全球第五大常见恶性肿瘤,在中国五年生存率仅约70%,其高复发率和治疗抵抗性始终是临床面临的重大挑战。传统化疗方案如晚间化疗虽能部分缓解症状,但对晚期患者效果有限,特别是伴有腹膜转移的病例预后极差。近年来,铁死亡(ferroptosis)——一种铁依赖性脂质过氧化驱动的细胞死亡方式,在肿瘤治疗领域崭露头角。其中ACSL4(长链脂酰辅酶A合成酶4)被证实是调控铁死亡的关键分子,但其在胃癌中的调控机制尚不明确。与此同时,泛素连接酶UBE2C在多种癌症中异常高表达,与染色体不稳定性密切相关,但其是否参与铁死亡调控仍是未解之谜。
兰州大学第一医院的研究团队在《Discover Oncology》发表的重要研究,首次揭示了UBE2C通过泛素化降解ACSL4抑制铁死亡促进胃癌进展的分子机制。研究人员整合TCGA和GSE27342数据集分析,结合免疫共沉淀-质谱(IP-MS)、K48特异性泛素化实验等技术,构建了从分子互作到动物模型的完整证据链。关键技术包括:基于TCGA/GEO数据库的生物信息学分析;UBE2C-ACSL4相互作用的免疫共沉淀验证;K48连接特异性泛素化检测;GSH干预的裸鼠移植瘤模型;以及铁死亡标志物(Fe2+、MDA、GSH)的ELISA检测。
研究结果部分:
3.1 UBE2C在胃癌中的高表达与铁死亡关联
通过分析375例胃癌和391例正常组织的TCGA数据,发现UBE2C在肿瘤组织中显著上调(log2FC>1),与ACSL4表达呈负相关。RNA-seq显示UBE2C敲除后336个差异基因富集于铁死亡通路,普鲁士蓝染色证实胃癌组织存在铁沉积减少特征。
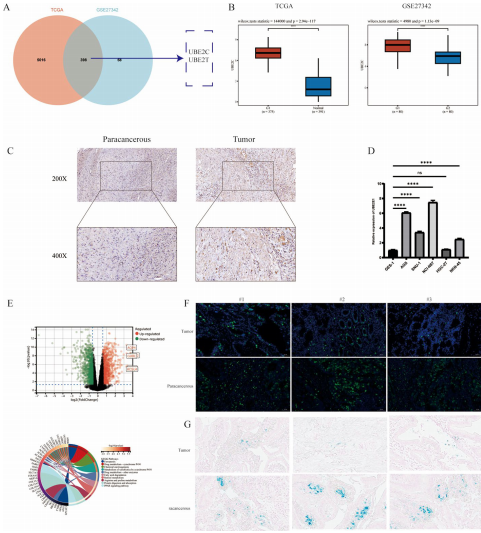
3.2 UBE2C沉默抑制胃癌恶性表型
在AGS和NCI-N87细胞系中,shRNA沉默UBE2C使细胞增殖率下降42%(CCK8法),Transwell侵袭细胞数减少68%。同时ROS水平升高2.3倍,Fe2+含量增加1.8倍,提示铁死亡激活。
3.3 UBE2C与ACSL4的直接相互作用
免疫共沉淀结合质谱鉴定出ACSL4是UBE2C的结合蛋白,计算对接显示两者存在稳定结合界面(PyDock评分>120)。免疫荧光显示二者在胞质共定位,组织检测显示UBE2C高表达样本ACSL4蛋白水平降低53%。
3.4 UBE2C介导ACSL4的K48泛素化降解
CHX追踪实验显示UBE2C过表达使ACSL4半衰期从12h缩短至4h。K48-only泛素突变体转染实验证实UBE2C特异性促进K48连接的多聚泛素化,蛋白酶体抑制剂MG132可逆转这种降解效应。
3.5 ACSL4敲除挽救UBE2C表型
ACSL4 siRNA转染使UBE2C沉默细胞的Fe2+积累减少61%,同时GPX4和SLC7A11蛋白表达恢复。伤口愈合实验显示迁移能力回升至对照组的85%,证实ACSL4是UBE2C功能的下游效应器。
3.6 GSH逆转UBE2C的促瘤效应
在裸鼠模型中,UBE2C过表达使肿瘤体积增大2.1倍,而GSH处理(100mg/kg/天)使MDA水平降低47%,NADPH恢复至正常组82%。Western blot显示FTH和ACSL4蛋白变化与铁死亡标志物一致。
讨论部分指出,该研究首次阐明UBE2C-ACSL4轴通过K48连接的泛素化降解抑制铁死亡的分子机制,为解释胃癌细胞如何逃逸铁死亡提供了新视角。特别值得注意的是,GSH干预实验证实调节该通路可影响肿瘤进展,这为开发靶向铁死亡的联合治疗方案提供了理论依据。但研究也存在局限,如未考察其他E3连接酶对ACSL4的调控,GSH单独处理组的缺失也影响结论的全面性。未来需要探索UBE2C抑制剂与铁死亡诱导剂的联合治疗效果,以及该通路在胃癌分子分型中的临床价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘