
-

生物通官微
陪你抓住生命科技
跳动的脉搏
儿童垂体腺瘤的遗传学评估及USP8相关基因型-表型关联在库欣病中的研究意义
【字体: 大 中 小 】 时间:2025年08月16日 来源:Pituitary 3.4
编辑推荐:
本研究针对儿童垂体腺瘤(PA)的发病机制尚不明确的问题,由美国国立卫生研究院(NIH)团队开展了一项关于遗传缺陷与临床表型关联的研究。通过对54例患儿进行种系和肿瘤测序,发现25.9%患者存在致病性变异,其中USP8体细胞变异与库欣病(CD)患儿更大的肿瘤体积(9.5mm vs 6.0mm,p=0.048)和更高手术未缓解率(33.3% vs 0%,p=0.021)显著相关。该研究为儿童垂体腺瘤的精准诊疗提供了重要分子标志物。
垂体腺瘤在儿童中虽属罕见疾病,却是导致生长异常和内分泌紊乱的重要病因。其中,分泌促肾上腺皮质激素(ACTH)的肿瘤引发库欣病(CD),而生长激素(GH)过量则导致巨人症。令人困惑的是,这些肿瘤在儿童患者中往往表现出与成人不同的临床特征,但背后的分子机制却鲜为人知。更棘手的是,约40%的儿童病例对现有治疗效果不佳,迫切需要揭示其遗传学基础来指导精准治疗。
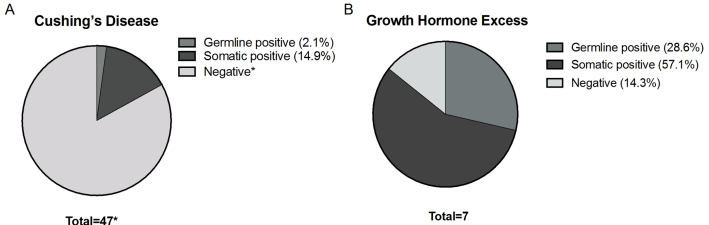
为解开这个谜团,美国国立卫生研究院儿童健康与人类发展研究所(NICHD)的研究团队开展了一项系统性研究。他们收集了54例儿童垂体腺瘤患者的临床样本,包括47例CD和7例GH过量(GHE)病例,采用全基因组测序(WGS)技术对种系和肿瘤DNA进行深度分析。研究聚焦于66个已知与垂体肿瘤发生相关的基因,包括USP8、GNAS等热点基因,旨在建立遗传变异与临床特征的关联图谱。
在技术方法上,研究人员采用标准化流程进行样本处理:从外周血白细胞提取种系DNA,使用KAPA Hyper试剂盒构建文库,在Illumina NovaSeq 6000平台进行30×深度测序;肿瘤样本通过Quick-DNA试剂盒提取DNA,对ACTH瘤进行USP8基因(713-720密码子)热点筛查,GH瘤进行GNAS基因(201和227密码子)检测,部分样本还进行了60×深度的全基因组测序。生物信息学分析采用Trimmomatic进行质控,bwa-mem比对到GRCh38参考基因组,GATK流程进行变异检测,并通过多款软件进行变异功能预测。
研究结果部分揭示了重要发现:
种系遗传检测方面,在53例样本中检出3例(5.7%)致病性变异:两例GHE患者携带AIP基因已知致病突变(c.811C>T和c.241C>T),一例CD患者发现CDKN2A基因新发变异(c.146T>C)。值得注意的是,AIP突变患者均表现为大腺瘤(中位直径22mm),且其中一例呈现侵袭性病程。
肿瘤基因检测方面,45例样本中检出11例(24.4%)体细胞变异:GHE组中57.1%(4/7)携带GNAS激活突变,CD组中15.8%(6/38)存在USP8突变。此外,一例特殊肿瘤同时检出PRKAR1A、TP53和MEN1三个基因的致病突变。
在关键的基因型-表型关联分析中,USP8突变阳性的CD患者展现出显著差异:肿瘤体积更大(9.5mm vs 6.0mm,p=0.048),海绵窦侵犯倾向更高(50% vs 12.5%,p=0.06),术后未缓解风险增加(33.3% vs 0%,p=0.021)。
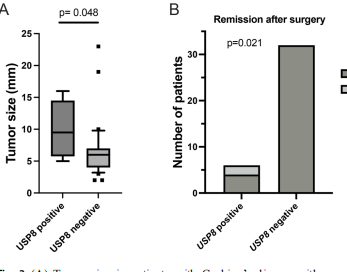
这项发表在《Pituitary》的研究得出了几个重要结论:首先,儿童垂体腺瘤存在独特的遗传图谱,GHE病例主要由GNAS和AIP变异驱动,而CD病例中仅15.8%与USP8相关,提示多数促肾上腺皮质激素瘤的遗传基础仍待阐明。其次,USP8突变可作为儿童CD的预后标志物,这类患者需要更积极的治疗和密切随访。最后,研究发现CDKN2A等新型候选基因,为后续研究开辟了新方向。
从临床转化角度看,该研究具有双重意义:一方面为儿童垂体瘤的分子分型提供了框架,USP8检测可指导手术决策和预后评估;另一方面揭示了当前认知空白,75%的儿童CD病例仍缺乏遗传学解释,这激励着更深入的机制研究。正如作者强调的,未来需要扩大样本量并探索USP8突变导致侵袭性表型的分子通路,这些发现终将造福于儿童内分泌肿瘤的精准医疗。
 生物通微信公众号
生物通微信公众号
知名企业招聘