
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:分子模拟驱动T细胞介导的肿瘤免疫
【字体: 大 中 小 】 时间:2025年08月17日 来源:TRENDS IN Immunology 13.9
编辑推荐:
这篇综述创新性地揭示了微生物抗原(MAA)与肿瘤相关抗原(TAA)的分子模拟(molecular mimicry)机制,通过交叉反应性T细胞(TCR-pMHC)激活抗肿瘤免疫。文章系统梳理了从抗原发现(如HIV、SARS-CoV-2衍生肽)到临床转化(如ICB联合FLach肽疫苗)的全链条证据,为开发广谱抗癌疫苗提供了新范式。
免疫系统通过耐受机制区分自身与外来抗原,但微生物抗原(MAA)与肿瘤相关抗原(TAA)的结构相似性可打破这种平衡。研究表明,B细胞和T细胞可能因分子模拟对自身抗原产生交叉反应,例如HIV的Env蛋白与癌胚抗原(CEA)的IMIGVLVGV表位共享核心序列,诱发保护性免疫。
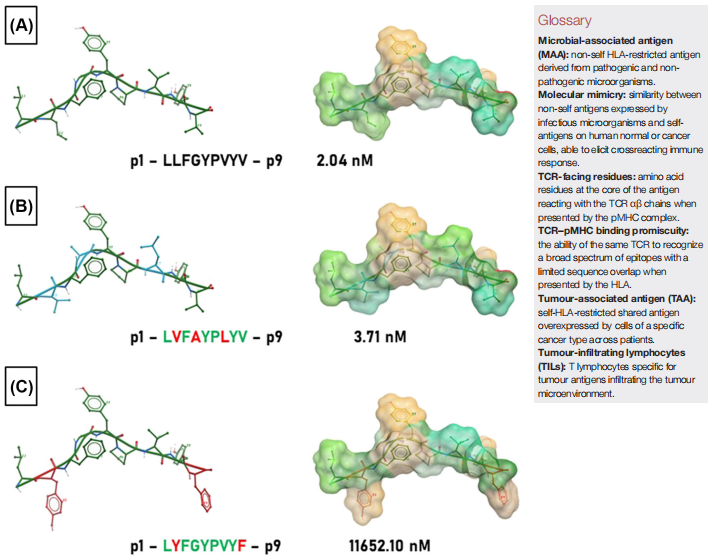
精准预测分子模拟需满足三个条件:短肽(8-15氨基酸)同源性、相同HLA限制性(如HLA-A*02:01)及一致的TCR接触核心(p3-p8)。例如,流感B病毒的KMDEEHPGL与胃癌抗原Secernin 1的KMDAEHPEL仅差一个氨基酸,但因核心ELPYP序列相同仍可被同一TCR识别。
TCR的天然低亲和力特性使其能识别多达106种不同pMHC复合物。结构分析显示,即使非锚定残基不同(如p2苯丙氨酸替换为亮氨酸),只要核心接触区(图2绿色区域)保守,T细胞仍可交叉反应。

病毒抗原:HIV的Vpu蛋白与结肠癌EPCAM表位、SARS-CoV-2 ORF1ab与黑色素瘤MDK表位(ALLALTSAV)均能激活交叉反应T细胞,在健康人中检出率高达9%。
菌群抗原:肠道拟杆菌的MAGE-A3模拟肽在70%健康人外周血中诱导TAA反应,证实微生物暴露可建立天然抗癌免疫记忆。
瘤内细菌:胶质瘤中细菌衍生的MHC-II肽通过共享非锚定残基激活肿瘤浸润淋巴细胞(TILs)。
基于FLach肽(Lachnospiraceae鞭毛蛋白模拟TAAs)的疫苗联合PD-1抑制剂在黑色素瘤试验中显示显著疗效。四项I/II期试验(如SIDNEY试验靶向CD20/CD22)证实:
安全性:322例患者无≥3级不良反应
免疫原性:所有响应者均出现MAA/TAA交叉反应性CD8+ T细胞扩增
疗效:疫苗联合来那度胺的完全缓解率达55.6%
尽管分子模拟为"现成"疫苗开发铺路,但需警惕:
微生物持续感染可能导致T细胞耗竭(如HIV慢性感染削弱抗癌应答)
自身免疫风险需评估(尽管MAAs为天然抗原,风险较低)
未来方向包括高危人群预防性接种(如肝硬化患者)及多靶点疫苗设计(覆盖MAGE-A3/CEA等共享TAAs)。

 生物通微信公众号
生物通微信公众号
知名企业招聘