
-

生物通官微
陪你抓住生命科技
跳动的脉搏
双氢青蒿素通过ROS介导的氧化应激机制抑制果蝇脑肿瘤并恢复功能
【字体: 大 中 小 】 时间:2025年08月18日 来源:Scientific Reports 3.9
编辑推荐:
本研究针对胶质瘤治疗中天然产物精确治疗的迫切需求,以果蝇l(2)gl/l(2)gl脑肿瘤模型为研究对象,系统评估了双氢青蒿素(DHA)的抗肿瘤效应。研究发现250μM DHA能完全抑制脑部和翅盘肿瘤,挽救致死表型并恢复运动功能,其机制与瞬时ROS水平超阈值升高相关,为胶质瘤治疗提供了新型候选药物。
胶质瘤作为最具侵袭性的脑肿瘤之一,传统治疗面临特异性差、毒性大等瓶颈。印度布巴内斯瓦尔国家科学教育与研究院(NISER)的研究团队创新性地利用果蝇l(2)gl/l(2)gl脑肿瘤模型,发现抗疟疾药物青蒿素的衍生物双氢青蒿素(DHA)展现出显著治疗潜力。这项发表在《Scientific Reports》的研究揭示,DHA不仅能逆转肿瘤表型,还能实现致死率挽救和功能恢复,其机制与独特的氧化应激调控相关。
研究采用剂量响应实验、BrdU标记、DHE荧光检测等技术,通过分析脑组织形态、细胞增殖模式、ROS水平及行为学指标,系统评估了DHA的疗效。关键发现包括:
DHA通过有效抑制肿瘤生长挽救致死率
剂量实验显示250μM DHA使突变体脑体积从157×103μm2恢复至野生型水平(102×103μm2),翅盘结构同步修复。更突破性的是,该剂量使97%幼虫完成蛹化,75%成功羽化为成虫,这是首次在该模型中实现发育全程挽救。
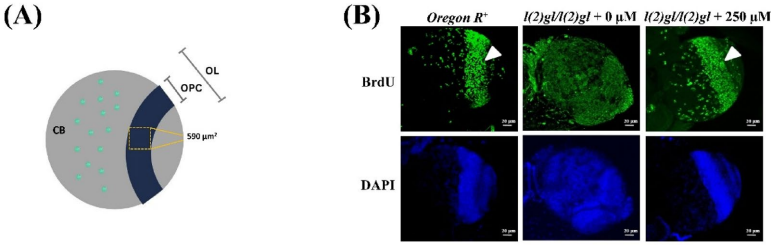
免疫染色显示复制细胞环状结构重建
BrdU标记显示DHA处理使突变体神经母细胞增殖中心标记细胞从10个恢复至28个/590μm2,重建了野生型特有的同心圆排列模式,证实DHA可规范肿瘤细胞的失控增殖。
ROS介导的抗肿瘤机制
DHE检测揭示DHA引发早期ROS水平1.4倍升高(54.2×103 RFU),后期回落至野生型水平(25.9×103 RFU)。这种"脉冲式"氧化应激可能通过铁离子复合物选择性杀伤肿瘤细胞,同时避免正常组织损伤。
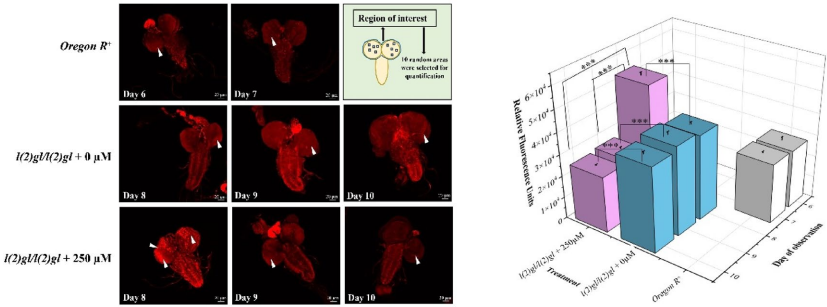
运动功能全面恢复
行为学分析显示DHA处理使幼虫爬行距离从11.7mm恢复至25.8mm/30s,成虫负趋地性测试达到野生型水平(17/20个体完成7cm攀爬),证实神经功能修复。
持续给药的必要性
多代实验表明停药两代后肿瘤复发,脑体积回升至128×103μm2,但重新给药仍可逆转表型,提示DHA需维持治疗浓度。有趣的是,亲代药物暴露可使子一代保持无瘤状态,暗示可能存在表观遗传调控。
该研究首次在动物模型中证实DHA通过时空特异性ROS调控实现胶质瘤的多维度抑制,其对人源LLGL-1同源基因的调控作用尤其值得关注。相较于传统化疗药物,DHA展现出的发育毒性低、功能恢复全面等优势,为转化医学研究提供了新方向。未来需在哺乳动物模型中验证其血脑屏障穿透性及与标准疗法的协同效应,同时深入解析ROS波动与表观遗传修饰的具体关联机制。
 生物通微信公众号
生物通微信公众号
知名企业招聘