
-

生物通官微
陪你抓住生命科技
跳动的脉搏
AAV介导的STC-1基因治疗通过调控CX3CL1/CX3CR1/NF-κB轴延缓视网膜退行性病变的机制研究
【字体: 大 中 小 】 时间:2025年08月19日 来源:Journal of Translational Medicine 7.5
编辑推荐:
本研究针对视网膜退行性病变(RD)缺乏有效治疗手段的临床难题,通过构建pAAV2/8-Stc1载体,在NaIO3诱导的小鼠模型中验证了STC-1基因治疗的神经保护作用。研究发现,AAV介导的STC-1过表达能显著抑制氧化应激和神经炎症反应,通过调控CX3CL1/CX3CR1/NF-κB信号通路改善视网膜结构和视觉功能,为退行性视网膜病变提供了新型基因治疗策略。该成果发表于《Journal of Translational Medicine》,具有重要转化医学价值。
在眼科疾病领域,视网膜退行性病变(RD)如同一个无声的"视觉窃贼",每年导致全球数百万人逐渐丧失视力。这种疾病以进行性光感受器凋亡为特征,伴随严重的神经炎症和氧化应激损伤。尽管已发现250多个相关基因突变,但由于病理机制复杂,现有治疗手段难以遏制疾病进展。更棘手的是,传统药物治疗面临血视网膜屏障穿透性差、半衰期短等技术瓶颈,而反复眼内注射又可能引发视网膜脱离等严重并发症。面对这些挑战,河南眼科研究所的研究团队将目光投向了具有多重神经保护作用的STC-1蛋白,并创新性地采用AAV载体实现其长效表达,为突破治疗困境提供了新思路。
研究团队主要运用了以下关键技术:1) 构建pAAV2/8-CMV-Stc1-3xFLAG重组载体并通过玻璃体腔注射实现视网膜靶向递送;2) 采用50 mg/kg NaIO3腹腔注射建立RD小鼠模型;3) 通过多焦视网膜电图(mf-ERG)和光/暗箱行为学测试评估视觉功能;4) 利用DHE染色和TUNEL检测分析氧化应激与细胞凋亡;5) 采用Western blot和免疫荧光技术解析CX3CL1/CX3CR1/NF-κB信号通路调控机制。
STC-1促进NaIO3处理的661W细胞存活
通过CCK8实验确定NaIO3对661W光感受器细胞的IC50为4 mM。转染pcDNA3.1-Stc1质粒可显著提升细胞活力至89.66%,效果与阳性对照NAC相当。TUNEL和流式细胞术证实STC-1过表达使细胞凋亡率降低65.32%,同时DHE染色显示ROS水平下降约50%。
STC-1过表达减轻RD模型视网膜损伤

pAAV2/8-Stc1注射28天后,视网膜中检测到26 kDa的STC-1蛋白特异性表达。眼底照相显示治疗组病变范围缩小40%,OCT测量显示神经视网膜厚度增加35%。HE染色证实外核层(ONL)厚度和视紫红质(RHO)阳性区段分别增加42%和38%,TUNEL阳性细胞数减少60%。
STC-1改善视觉功能
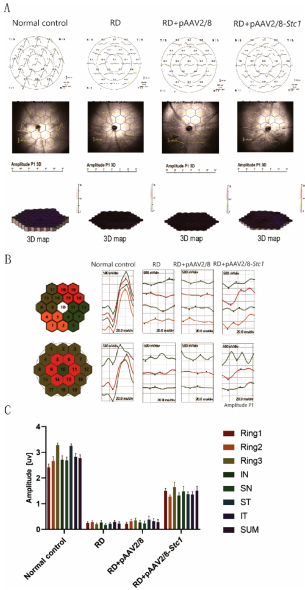
mf-ERG显示治疗组在ST、IT、SN、IN四个象限的P波振幅提升2-3倍。行为学测试中,光/暗箱穿梭次数增加75%,在暗箱停留时间缩短40%,表明视觉引导行为明显改善。
机制解析:调控CX3CL1/CX3CR1/NF-κB轴
Western blot显示治疗组IL-1β和TNF-α表达量降低50-60%,同时CX3CL1/CX3CR1通路关键蛋白磷酸化水平下降45%。免疫荧光证实小胶质细胞标志物IBA1和星形胶质细胞标志物GFAP表达减少55%,表明神经胶质细胞活化受到抑制。
这项研究首次系统阐明了STC-1通过"抗氧化-抗炎-抗凋亡"三重机制保护视网膜功能的分子通路。特别值得注意的是,AAV载体单次注射即可实现长达28天的稳定表达,避免了反复给药的临床风险。从转化医学角度看,该策略为遗传性视网膜病变如视网膜色素变性(RP)提供了潜在治疗方案。但研究者也指出,NaIO3诱导的急性模型与慢性RD存在差异,未来需要在rd10小鼠等遗传模型中进行长期安全性评估。此外,STC-1对VEGF通路的抑制作用提示其在湿性年龄相关性黄斑变性(nAMD)中的潜在应用价值,这为拓展该技术的适应症范围提供了新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘