
-

生物通官微
陪你抓住生命科技
跳动的脉搏
癫痫中miRNA-129-5P/HMGB1/补体系统交互作用的新机制:丙戊酸治疗反应的生物标志物探索
【字体: 大 中 小 】 时间:2025年08月20日 来源:The Egyptian Journal of Neurology, Psychiatry and Neurosurgery 1.1
编辑推荐:
本研究聚焦癫痫患者血清中miRNA-129-5P、miRNA-146a和miRNA-155与高迁移率族蛋白B1(HMGB1)、补体成分C1q/C3的关联,揭示丙戊酸(VPA)通过调控该网络改善癫痫发作。发现VPA可显著降低HMGB1及补体水平,并差异化调节miRNAs表达,为癫痫诊断和治疗监测提供新型分子靶点。
癫痫作为全球约5000万患者受累的神经系统疾病,近30%病例存在耐药性问题。近年研究发现,微小RNA(miRNA)与神经炎症的异常调控可能是癫痫发生发展的关键环节。其中,高迁移率族蛋白B1(HMGB1)作为危险信号分子,通过激活小胶质细胞和补体系统加剧神经兴奋性,而某些miRNAs可能通过表观遗传调控参与这一过程。然而,这些分子如何相互作用,以及常用抗癫痫药物丙戊酸(VPA)如何影响该网络,仍是亟待解决的科学问题。
来自埃及亚历山大大学的研究团队在《The Egyptian Journal of Neurology, Psychiatry and Neurosurgery》发表的研究,首次系统探索了癫痫患者血清中miRNA-129-5P、miRNA-146a和miRNA-155与HMGB1-补体系统的交互作用。研究纳入41例初诊癫痫患者、40例VPA治疗患者及41例健康对照,采用ELISA检测HMGB1、C1q和C3b水平,通过实时定量PCR分析miRNAs表达谱,并评估其与癫痫发作频率的相关性。
血清免疫炎症生物标志物
研究发现初诊癫痫患者血清C1q和C3水平显著升高,而VPA治疗可使二者恢复至正常水平。HMGB1在两组癫痫患者中均显著增高,但VPA组较未治疗组降低约30%,提示VPA可能通过抑制HMGB1-TLR4信号通路发挥抗炎作用。
血清miRNAs表达特征
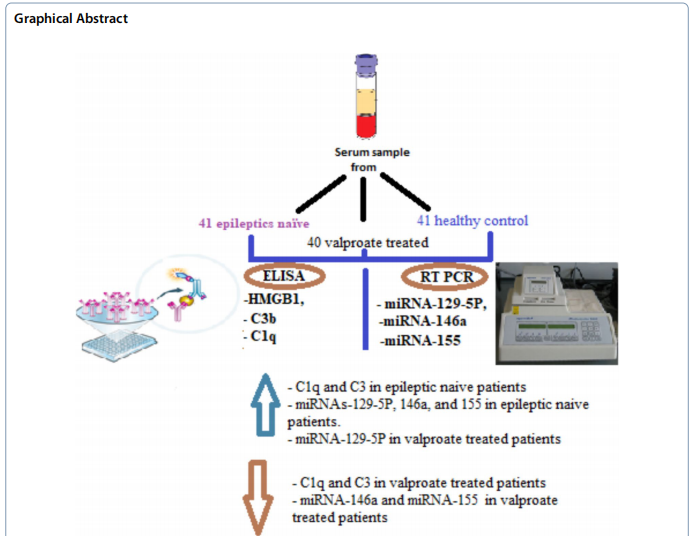
三种miRNAs在癫痫患者中均显著上调,但VPA呈现差异化调控:miRNA-129-5P进一步升高2.1倍,而miRNA-155和miRNA-146a分别下降40%和25%。值得注意的是,miRNA-146a/155水平与癫痫发作频率呈正相关(r=0.56/0.59),而miRNA-129-5P则呈负相关,提示其可能通过抑制HMGB1发挥保护作用。
分子互作网络
研究揭示了一个关键调控环路:癫痫发作→HMGB1释放→激活补体C1q-C3级联→促进神经炎症→加重癫痫发作。VPA通过三重机制打破该恶性循环:(1)直接抑制HMGB1释放;(2)上调miRNA-129-5P负反馈抑制HMGB1;(3)下调促炎性miRNA-155/146a。
这项研究的重要意义在于:首次建立癫痫中"miRNA-HMGB1-补体"交互网络的理论框架,阐明VPA治疗反应的部分分子机制。发现的miRNA组合可作为预测VPA疗效的生物标志物,其中miRNA-129-5P的上调尤其具有临床转化价值,为开发新型抗癫痫药物提供潜在靶点。研究也存在局限性,如未检测脑脊液标志物相关性,未来需扩大样本验证不同癫痫亚型的特异性分子特征。
 生物通微信公众号
生物通微信公众号
知名企业招聘