
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:创新方法对抗抗生素耐药性:整合CRISPR/Cas9和纳米颗粒对抗生物膜驱动的感染
【字体: 大 中 小 】 时间:2025年08月21日 来源:BMC Medicine 8.3
编辑推荐:
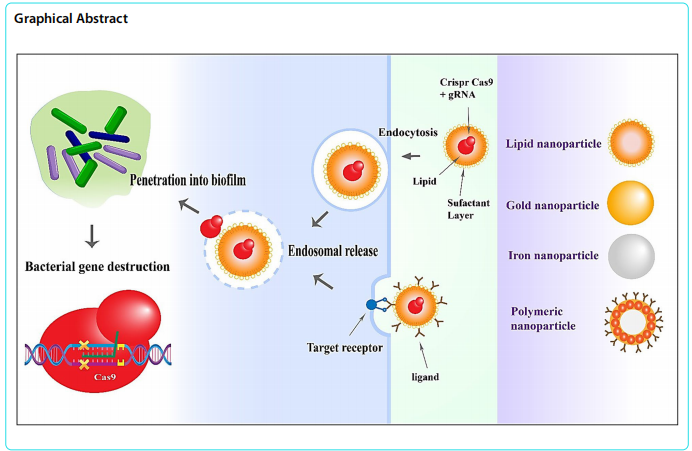
这篇综述系统阐述了整合CRISPR/Cas9基因编辑技术与纳米颗粒(NPs)的创新策略,用于对抗生物膜(biofilm)介导的抗生素耐药性。文章详细解析了生物膜的三维结构(EPS基质)如何通过限制抗生素渗透、促进水平基因转移(HGT)和形成持久细胞(persisters)导致治疗失败,并重点探讨了CRISPR-Cas9系统精准靶向耐药基因(如bla、mecA)、群体感应(QS)通路(lasR/rhlR)和胞外聚合物(pel/psl)的分子机制。通过纳米载体(如脂质体、金纳米颗粒)递送CRISPR组件可显著提升生物膜穿透效率(如脂质体-Cas9使铜绿假单胞菌生物膜减少90%),与抗生素联用产生协同效应。该跨学科策略为慢性感染和植入器械相关感染提供了突破性解决方案。
抗生素耐药性危机与生物膜挑战
全球每年因抗生素耐药性导致的死亡病例高达70万例,其中生物膜相关感染是临床治疗的主要难点。生物膜作为微生物的"防护堡垒",其三维结构包含多糖、蛋白质和eDNA构成的胞外聚合物(EPS)基质,可降低抗生素渗透1000倍。这种物理屏障与代谢休眠的持久细胞(persisters)、活跃的耐药基因转移(如blaNDM-1)共同构成多重防御机制。
CRISPR-Cas9的精准打击
源自细菌免疫系统的CRISPR-Cas9技术,通过向导RNA(gRNA)引导Cas9核酸酶靶向切割特定DNA序列。在抗生物膜应用中,该系统可精准编辑三类关键靶点:①耐药基因(如mcr-1介导的粘菌素耐药);②群体感应(QS)调控基因(lasI/rhlI);③EPS合成基因(icaA/pelA)。实验证明,靶向铜绿假单胞菌lasR基因可使生物膜质量减少75%,而敲除金黄色葡萄球菌icaA基因则显著削弱其粘附能力。
纳米颗粒的智能递送
传统递送方式难以突破生物膜屏障,而功能化纳米颗粒展现出独特优势:
脂质体:保护CRISPR组件免受降解,对铜绿假单胞菌生物膜的穿透效率达90%
金纳米颗粒:通过表面等离子共振增强编辑效率3.5倍
pH响应型聚合物:在生物膜酸性微环境(pH 5.0-6.5)中触发释放
协同治疗新范式
CRISPR-NP系统与抗生素联用产生突破性效果:
金纳米颗粒携带Cas9靶向mecA基因,使MRSA恢复对β-内酰胺类药物的敏感性
脂质体共递送DNase与CRISPR组件,EPS降解使阿米卡星最小抑菌浓度降低8倍
噬菌体-CRISPR杂合系统选择性清除生物膜中的耐药亚群
挑战与展望
尽管前景广阔,该技术仍面临递送效率(体内<30%)、细菌抗CRISPR蛋白(Acr)逃逸、纳米材料长期毒性等挑战。未来发展方向包括:
开发Cas12a/Cas13等PAM要求更宽松的变体
设计群体感应激活的智能递送系统
建立生物膜微环境响应的动态治疗策略
这种融合基因编辑、纳米技术和微生物学的跨学科方法,为解决"后抗生素时代"的感染危机提供了全新范式,其应用范围可扩展至慢性伤口感染、人工关节感染等临床难题。
 生物通微信公众号
生物通微信公众号
知名企业招聘