
-

生物通官微
陪你抓住生命科技
跳动的脉搏
NME1自催化寡磷酸化修饰的发现:蛋白质翻译后修饰的新模式及其功能调控机制
【字体: 大 中 小 】 时间:2025年08月21日 来源:Nature Chemistry 20.2
编辑推荐:
研究人员针对蛋白质非经典磷酸化修饰机制,通过化学合成与遗传密码扩展技术获得位点特异性(吡咯)磷酸化NME1,发现其可催化自身形成长达六磷酸链的寡磷酸化修饰。该修饰依赖催化组氨酸His118,并通过冷冻电镜揭示分子内磷酸转移机制。研究拓展了真核细胞磷酸化调控的复杂性认知,为探索新型翻译后修饰提供了方法学范式。
在真核细胞信号传导中,蛋白质磷酸化是最核心的翻译后修饰机制之一。从经典的丝氨酸/苏氨酸/酪氨酸磷酸化,到近年发现的组氨酸、精氨酸等非经典磷酸化,再到蛋白质焦磷酸化(pyrophosphorylation)和多聚磷酸化(polyphosphorylation),这一修饰家族不断扩展其多样性边界。然而,位于核苷二磷酸激酶A(NME1)苏氨酸94位点(Thr94)的磷酸化修饰,虽在多项高通量研究中被反复检测到,其功能意义却始终成谜。这项发表在《Nature Chemistry》的研究,首次揭示了NME1通过自催化反应形成寡磷酸化链(oligophosphorylation)的全新修饰模式,为理解磷酸化调控网络的复杂性提供了全新视角。
研究团队采用遗传密码扩展技术在大肠杆菌中表达出位点特异性磷酸化的pS94-NME1(以丝氨酸替代苏氨酸提高产量),并通过光敏性P-咪唑试剂实现化学焦磷酸化,获得ppS94-NME1。关键实验技术包括:1)基于Q-TOF-MS和阶梯式HCD碎裂的质谱分析技术;2)冷冻电镜单颗粒分析(分辨率达2.8-3.8?);3)HEK293T细胞裂解物中内源性修饰的SIMAC富集策略;4)CDK1激酶活性检测与互作组学分析。
(Pyro)磷酸化降低NME1激酶活性
通过GDP/TDP底物实验发现,pS94-NME1的核苷二磷酸激酶活性较野生型降低100倍,而ppS94-NME1则完全失活。有趣的是,质谱检测到ppS94-NME1与ATP孵育后出现+360/+400 Da质量增加,提示可能存在超磷酸化现象。
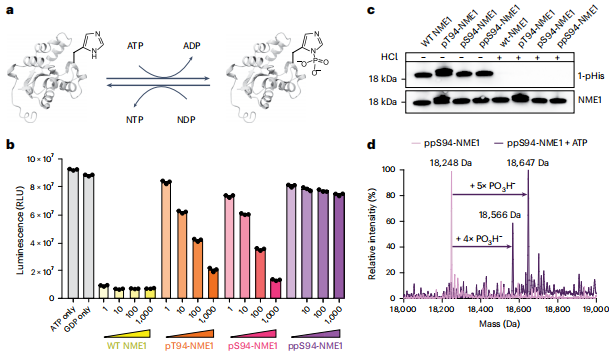
质谱揭示自催化寡磷酸化机制
优化阶梯式HCD碎裂参数(NCE=20-23-26)后,成功鉴定到Ser94位点连接三至六磷酸链的修饰肽段。这种修饰严格依赖催化残基His118,突变体pS94-NME1(H118F)完全丧失修饰能力。在HEK293T细胞裂解物中,通过λ-磷酸酶处理富集,首次证实内源性三/四磷酸化NME1的存在。
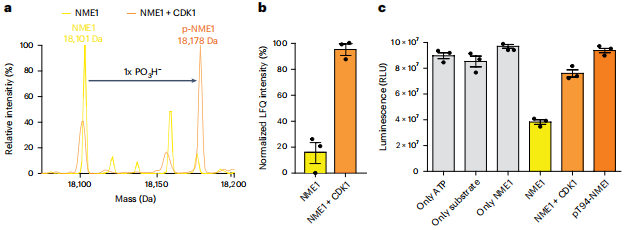
CDK1启动修饰级联反应
验证CDK1可磷酸化野生型NME1的Thr94,导致激酶活性显著降低。这解释了生理条件下寡磷酸化修饰的起始机制——CDK1提供的初始磷酸基团是后续自催化反应的唯一前提。
冷冻电镜解析分子内转移途径
2.8?分辨率结构显示pS94磷酸基团与His118距离6.6?,而ppS94的β-磷酸基团距离缩短至4.5?,密度图显示二者形成氢键桥。在寡磷酸化NME1的3.8?结构中,观察到表面延伸的电子密度,对称扩展分类揭示三/四磷酸化链的异质性取向。
寡磷酸化重塑蛋白质互作网络
互作组学分析发现,oligo-pS94-NME1特异性结合80种含多组氨酸/赖氨酸(polyH/K)序列的蛋白质,其中剪接体相关蛋白(如CWC22、SNIP1)显著富集。这些互作可能通过寡磷酸链与RNA骨架相似的负电特性介导。
这项研究不仅报道了蛋白质寡磷酸化这一全新修饰模式,更揭示了NME1作为"磷酸化反应平台"的多重功能:既能催化经典NDP激酶反应,又能通过His118介导磷酸基团的分子内转移。从技术层面看,开发的阶梯式HCD质谱方法和冷冻电镜解析策略,为未来寡磷酸化蛋白质组学研究树立了新标准。从生物学意义而言,NME1在肿瘤转移抑制中的作用可能与其修饰状态密切相关——CDK1启动的修饰级联通过抑制激酶活性并招募剪接体蛋白,或将重塑肿瘤细胞的信号传导网络。该发现为探索磷酸化修饰在RNA加工、细胞周期调控等过程中的非经典功能开辟了新途径。
 生物通微信公众号
生物通微信公众号
知名企业招聘