
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向巨噬细胞移动抑制因子(MIF)作为结直肠癌治疗新策略:从肿瘤维持机制到临床转化潜力
【字体: 大 中 小 】 时间:2025年08月21日 来源:Oncogenesis 6.4
编辑推荐:
本研究针对晚期结直肠癌(CRC)治疗困境,通过构建TP53突变基因工程小鼠模型,首次证实肿瘤上皮源性巨噬细胞移动抑制因子(MIF)通过HSP90稳定化机制对已建立肿瘤的维持作用。研究发现诱导性敲除Mif可显著抑制肿瘤生长,伴随巨噬细胞浸润减少和血管生成抑制,为开发靶向MIF的精准治疗方案提供了理论依据。
在癌症治疗领域,结直肠癌(CRC)晚期患者的生存率始终是难以突破的瓶颈。尽管筛查和手术技术不断进步,III期患者的5年生存率仍徘徊在65%左右,而IV期更骤降至10%。这种严峻现状背后,是现有治疗方案对肿瘤微环境复杂调控网络的无能为力。其中,巨噬细胞移动抑制因子(MIF)这个多面手细胞因子引起了科学家们的特别关注——它既是炎症反应的关键调控者,又在多种癌症中异常高表达,但关于它是否直接参与维持已形成肿瘤的生命线,始终是个未解之谜。
这项发表在《Oncogenesis》的研究犹如打开了一扇新窗。团队创造性地采用两种携带人类TP53R248Q突变的基因工程小鼠模型,分别模拟良性腺瘤(TP53Q/+)和恶性进展期(TP53Q/Q)结直肠癌。通过化学诱导(AOM/DSS)形成肿瘤后,利用villinCreERT2系统实现上皮特异性Mif条件性敲除,这种时空调控的精妙设计,完美模拟了临床干预场景。
关键技术方法包括:1)构建TP53R248Q突变杂合(TP53Q/+)与纯合(TP53Q/Q)基因工程小鼠;2)结肠镜动态监测肿瘤发展;3)免疫组化分析MIF表达与巨噬细胞(CD68)、血管(CD31)标记;4)siRNA敲低人CRC细胞系验证表型;5)Transwell实验评估细胞迁移能力。
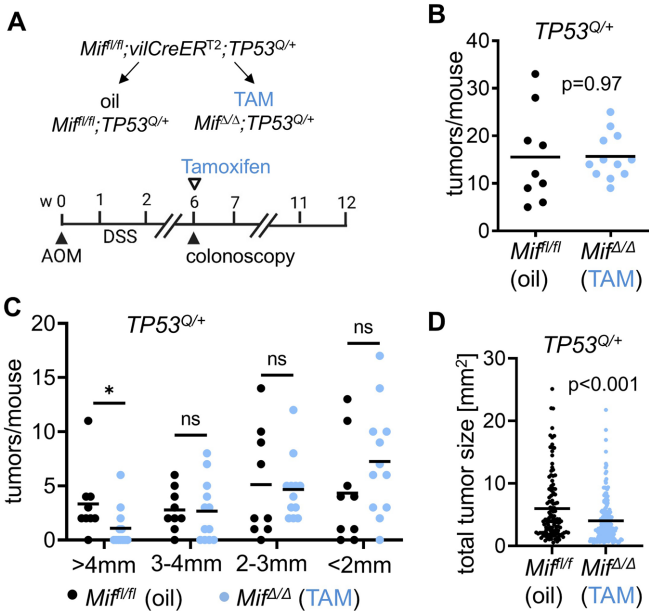
上皮肿瘤源性MIF对结直肠腺瘤维持至关重要
在TP53Q/+模型中,Tamoxifen诱导Mif敲除6周后,虽然肿瘤数量未变,但>4mm的大肿瘤显著减少(33.3%)。通过免疫组精确定量发现,MIF完全缺失的肿瘤面积缩小达57.9%,证实即便在已建立的肿瘤中,上皮MIF仍是不可或缺的生长引擎。
恶性CRC模型中遗传性MIF缺失抑制肿瘤生长
TP53Q/Q模型再现了更凶险的临床场景。诱导敲除5周后,肿瘤负荷显著减轻,但有趣的是,侵袭能力未受影响。这提示MIF主要调控增殖而非转移程序,为靶向治疗的安全性提供了重要线索。

急性清除上皮MIF抑制血管生成和巨噬细胞招募
无论TP53背景如何,MIF缺失均导致CD68+巨噬细胞浸润减少40-60%,CD31+血管密度降低30%,Ki67+增殖细胞减少45-50%。这种"一石三鸟"效应,揭示了MIF通过重塑肿瘤生态位维持恶性循环的机制。
讨论部分犹如一场分子侦探剧的收官。研究者指出,HSP90-MIF轴在肿瘤上皮的特异性稳定,创造了精准打击的"阿喀琉斯之踵"。与构成性敲除不同,诱导性模型证实即便在肿瘤微环境MIF健全的情况下,仅上皮MIF缺失就足以瓦解肿瘤生长。这种"肿瘤成瘾性"为开发HSP90抑制剂或oxMIF抗体等疗法提供了强有力依据。值得注意的是,MIF缺失不影响侵袭的表型,与多数CRC临床特征吻合,但也提示联合抗转移策略的必要性。
这项研究的深远意义在于:首次在时空维度证实上皮MIF是CRC维持的"致命弱点";建立的TP53R248Q梯度模型为不同阶段CRC研究提供了新工具;提出的HSP90-MIF靶向策略,有望突破现有治疗瓶颈。正如作者强调,将MIF从生物标志物提升为治疗靶点,可能改写晚期CRC的治疗格局。
 生物通微信公众号
生物通微信公众号
知名企业招聘