
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肌肉前体细胞外泌体在辐射损伤中的功能重塑:增殖与血管生成的双重调控机制及其治疗潜力
【字体: 大 中 小 】 时间:2025年08月21日 来源:Scientific Reports 3.9
编辑推荐:
本研究针对电离辐射损伤导致的肌肉再生障碍这一临床难题,揭示了健康肌肉前体细胞(MPCs)来源的细胞外囊泡(EVs)通过miRNA调控网络修复辐射损伤的关键机制。研究人员通过对比辐照(10 Gy)与非辐照MPCs分泌的EVs(NoRad-EVs vs Rad-EVs),发现NoRad-EVs能显著提升辐照MPCs的存活率(52%→71%)和增殖能力(BrdU检测+16%),并通过VEGF/PI3K-Akt/FoxO等通路促进血管生成(HUVEC管形成1.5倍,MVF血管密度3倍)。该研究为开发基于EVs的辐射损伤治疗策略提供了重要理论依据,尤其对军事医学和放射应急具有重大意义。
当核事故、放射治疗或恐怖袭击带来的电离辐射穿透人体时,骨骼肌作为高敏感组织首当其冲。辐射不仅直接损伤肌纤维,更会"冻结"肌肉前体细胞(MPCs)的再生能力——这些驻扎在肌肉中的干细胞样细胞本该在损伤时激活增殖,分化为新的肌细胞。但辐射引发的DNA损伤和氧化应激(ROS)使它们丧失功能,导致进行性肌肉萎缩和纤维化。更棘手的是,近年研究发现这些受损细胞还会通过分泌细胞外囊泡(EVs)向周围传递"死亡信号",加剧组织损伤的扩散。
面对这一难题,Umang Sharma团队在《Scientific Reports》发表的研究开辟了新思路。既然健康MPCs分泌的EVs(NoRad-EVs)能促进肌肉修复,那么辐射是否改变了EVs的"修复工具箱"?这些纳米级囊泡能否成为对抗辐射损伤的"生物导弹"?
研究人员运用多学科技术展开探索:通过超速离心分离辐照(10 Gy)与非辐照MPCs分泌的EVs;纳米颗粒追踪(NTA)和透射电镜(TEM)表征物理特性;采用BrdU掺入法和死活染色评估MPCs增殖活力;建立HUVEC二维管形成和微血管片段(MVF)三维培养模型量化血管生成;最后通过NanoString miRNA芯片解析分子机制。
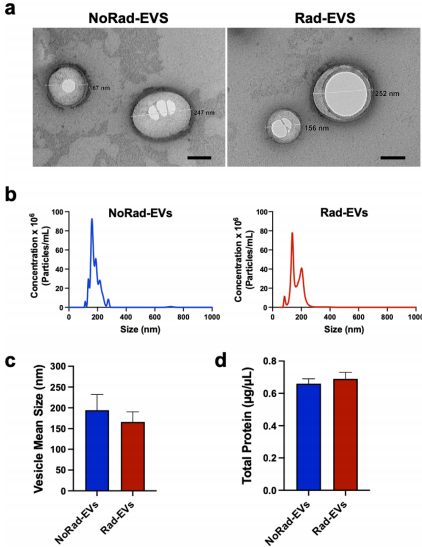
EVs形态相似但功能迥异
电镜显示NoRad-EVs与Rad-EVs均为100-300nm的圆形囊泡,蛋白浓度无差异(0.66 vs 0.69 μg/μL)。但功能实验揭示惊人差异:NoRad-EVs使辐照MPCs存活率从52±5.7%提升至71±4.9%,而Rad-EVs几乎无效。

血管再生能力的三重验证
在75μg剂量下,NoRad-EVs使HUVEC管分支长度增加1.5倍;更令人振奋的是,MVF实验显示NoRad-EVs组血管密度达到Rad-EVs组的3倍。这种促血管效应可能与miR-206(下调1.3倍)和let-7b(下调1.47倍)等关键miRNA相关,它们靶向调控VEGFA和SIRT1等血管生成核心基因。
miRNA指纹揭示分子开关
通过分析423种miRNA,发现Rad-EVs中13种miRNA下调、7种上调。生物信息学预测这些差异miRNA密集调控PI3K-Akt、FoxO和VEGF信号通路——恰是维持肌肉干细胞活力和血管生成的"生命线"。特别值得注意的是,let-7b的减少可能削弱细胞抗氧化能力,而miR-181a(上调1.48倍)的过度激活则会促进炎症反应。
这项研究首次系统阐释了辐射如何通过重塑EVs的miRNA cargo破坏肌肉微环境稳态。NoRad-EVs展现的"双重修复"能力——既挽救MPCs又重建血管网络,为开发无细胞治疗策略提供了分子蓝图。在军事医学领域,冻干保存的EVs或可成为战场核辐射损伤的"急救包";对癌症放疗患者,则可能预防肌肉萎缩等远期并发症。未来研究需在大型动物模型中验证疗效,并探索特定miRNA组合的协同效应,这将推动精准化EV疗法进入临床实践。
 生物通微信公众号
生物通微信公众号
知名企业招聘