
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道微生物代谢物TMAO通过调控GSK-3β活性损害海马突触可塑性并导致认知功能障碍的机制研究
【字体: 大 中 小 】 时间:2025年08月23日 来源:Alzheimer's Research & Therapy 8
编辑推荐:
本研究针对肠道菌群代谢物氧化三甲胺(TMAO)与认知障碍的关联机制,通过临床队列和动物模型揭示了TMAO通过抑制GSK-3β Ser9位点磷酸化,下调PSD95/Synapsin 1表达并促进GluA1内化,最终导致海马突触可塑性损伤的分子通路。该成果发表于《Alzheimer's Research》,为肠道-脑轴调控认知功能提供了新靶点。
肠道菌群与大脑的隐秘对话
现代医学逐渐揭示了一个惊人事实:人体肠道内数以万亿计的微生物正在通过代谢产物与大脑进行着持续对话。这些肉眼不可见的"房客"通过分解食物产生的小分子,不仅能影响消化和免疫,更可能左右着人类的情感和认知能力。其中,氧化三甲胺(TMAO)作为胆碱等营养物质经肠道菌群代谢的终产物,近年被发现与心脑血管疾病密切相关,但其对神经系统的影响机制仍如雾里看花。
随着全球老龄化加剧,轻度认知障碍(MCI)作为阿尔茨海默病(AD)的前驱阶段备受关注。令人警觉的是,多项临床研究显示MCI和AD患者脑脊液中TMAO水平显著升高,暗示这种肠道微生物代谢物可能参与了认知衰退的病理过程。然而,TMAO究竟如何穿越血脑屏障、通过何种分子机制损害认知功能,这些关键科学问题亟待解答。
多维度研究设计
南京医科大学附属无锡人民医院团队开展了为期两年的前瞻性队列研究,纳入115例MCI患者和128名健康对照,采用高效液相色谱-质谱联用技术检测血浆TMAO水平,并进行蒙特利尔认知评估(MoCA)等系列神经心理学测试。动物实验采用6月龄SD大鼠,通过胆碱饮食诱导内源性TMAO升高模型,结合TMAO直接干预组,运用Morris水迷宫评估空间认知功能,Western blotting检测海马组织GSK-3β磷酸化状态及突触相关蛋白表达。关键技术包括:临床队列的神经心理学评估体系、稳定同位素稀释质谱法检测TMAO、广谱抗生素(ABS)肠道菌群干预、GSK-3β特异性抑制剂SB216763药理学阻断等。
临床发现:TMAO与认知障碍显著相关
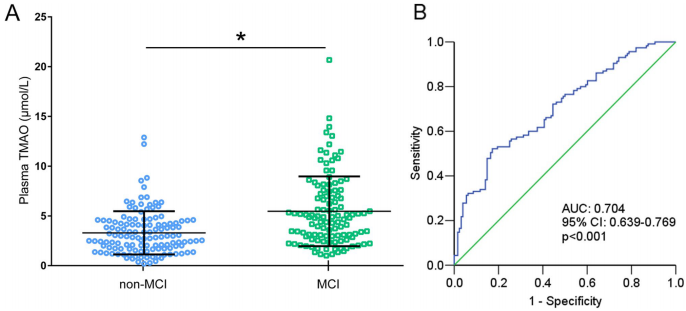
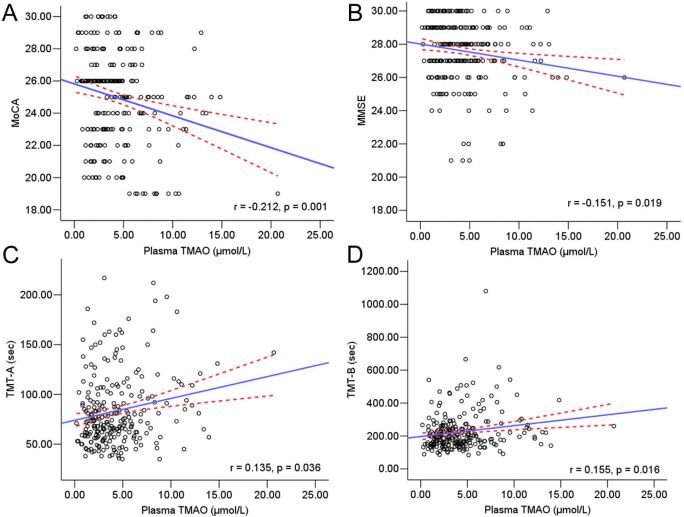
研究结果显示,MCI患者血浆TMAO中位数达4.88 μmol/L,显著高于健康对照组的2.87 μmol/L。受试者工作特征(ROC)曲线分析显示,TMAO区分MCI的曲线下面积(AUC)为0.704,最佳截断值4.74 μmol/L时特异性达82.8%。多因素校正后,TMAO最高四分位数组的MCI风险是最低组的6.95倍。值得注意的是,TMAO水平与MoCA评分呈显著负相关,这种关联独立于年龄、心血管危险因素等混杂变量。
动物实验揭示分子机制
在胆碱饮食大鼠模型中,6个月干预导致:
空间记忆受损:水迷宫测试显示逃避潜伏期延长40%,平台穿越次数减少55%,靶象限停留时间下降32%。广谱抗生素干预可逆转这些行为缺陷。
GSK-3β异常激活:海马组织GSK-3β Ser9位点磷酸化水平降低46%,而Tyr216位点无显著变化,表明特异性激活了该激酶活性。
突触蛋白表达异常:突触后密度蛋白95(PSD95)和突触素I(Synapsin 1)表达分别下降38%和42%,AMPAR亚基GluA1膜定位减少35%。
关键验证实验显示,GSK-3β抑制剂SB216763处理可:
使TMAO处理组的平台穿越次数恢复至对照组的85%
将PSD95和Synapsin 1表达提升至正常水平的90%
阻止GluA1膜定位的下降
讨论与展望
该研究首次系统阐明了"肠道菌群-TMAO-GSK-3β-突触可塑性"的完整病理链条:膳食胆碱经肠道微生物代谢产生TMAO,后者通过降低GSK-3β Ser9磷酸化解除对该激酶的抑制,活化的GSK-3β进而磷酸化PSD95导致其稳定性下降,最终引发AMPAR内化和突触功能损伤。这一发现为理解肠道-脑轴在认知障碍中的作用提供了分子水平的解释。
研究创新性体现在三方面:
临床证实TMAO作为MCI独立风险标志物的价值
动物模型揭示TMAO通过GSK-3β损害突触可塑性的新机制
证明抗生素和GSK-3β抑制剂的干预潜力
该成果对临床实践具有重要启示:监测中老年人群TMAO水平可能有助于早期识别认知衰退高风险个体;调节肠道菌群或靶向GSK-3β信号通路可能成为防治MCI的新策略。未来研究需扩大样本验证TMAO的预测价值,并探索TMAO通过血脑屏障的具体转运机制。
 生物通微信公众号
生物通微信公众号
知名企业招聘