
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Elongator复合体缺失通过TDP-43核仁清除驱动肌萎缩侧索硬化症(ALS)的分子机制研究
【字体: 大 中 小 】 时间:2025年08月23日 来源:Communications Biology 5.1
编辑推荐:
本研究通过构建脊髓α运动神经元特异性敲除Elongator亚基Elp1/Elp3的小鼠模型,首次揭示Elongator功能障碍导致TDP-43从核仁清除的病理机制。研究人员发现TDP-43在野生型运动神经元核仁中富集(1.77倍),而Elp条件性敲除小鼠出现进行性运动障碍、运动神经元变性及TDP-43核/核仁清除现象。该研究为理解ALS中TDP-43病理与核仁应激的关联提供了直接证据,发表于《Communications Biology》。
在神经退行性疾病研究领域,肌萎缩侧索硬化症(ALS)因其快速进展性和高致死率备受关注。这种疾病选择性攻击控制随意肌的运动神经元,患者通常在确诊后5年内死亡。尽管90%的ALS病例为散发性,但97%的病例都存在TDP-43蛋白异常聚集这一标志性病理特征。有趣的是,TDP-43作为重要的RNA代谢调控因子,其核功能丧失与细胞毒性聚集体的形成孰为疾病主因,一直是学界争论的焦点。与此同时,近年研究发现核仁应激是ALS的早期共同特征,而Elongator复合体(由ELP1-ELP6亚基组成)功能障碍与ALS遗传易感性相关,但其具体致病机制尚不明确。
为破解这一科学难题,由Lynn George领衔的研究团队在《Communications Biology》发表了突破性成果。研究人员采用多学科交叉方法,通过构建Chat-Cre介导的脊髓运动神经元特异性Elp1/Elp3条件性敲除(CKO)小鼠模型,结合定量免疫荧光、神经肌肉接头分析和行为学测试等技术,系统研究了Elongator缺失导致的分子与细胞病理变化。
关键技术方法包括:1)利用Chat-Cre; Rosa mTmG系统验证胆碱能神经元特异性重组;2)通过Paw Grip Endurance(PaGE)测试量化运动功能缺损;3)采用Chat-GFP标记与NeuN免疫荧光共定位定量α运动神经元;4)使用RRM2结构域特异性抗体(10782-2-AP)检测TDP-43亚细胞定位;5)通过fibrillarin标记评估核仁完整性。
研究结果揭示:
【Elongator亚基在运动神经元表达】

通过Elp1-LacZ报告基因与Chat-GFP双标记,证实Elp1和Elp3均在脊髓腹角大直径(≥440μm2)α运动神经元和小型γ运动神经元中表达。
【Elp CKO小鼠表现ALS样表型】
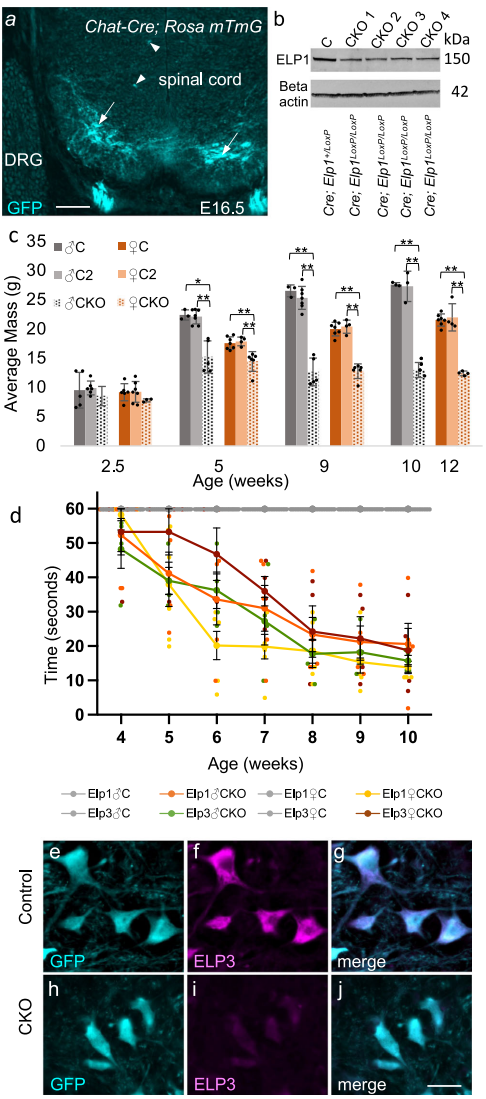
Elp1/Elp3 CKO小鼠在4周龄出现进行性运动无力,6周时α运动神经元数量减少57%(雄性)和64%(雌性),9周时神经肌肉接头(NMJ)出现显著失神经支配。值得注意的是,雄性表型更严重,90%在10周达到人道终点。
【TDP-43核仁定位与清除现象】
定量免疫荧光显示野生型运动神经元中TDP-43在核仁富集1.77倍(与质谱研究1.45倍结果一致)。Elp1 CKO小鼠在2周龄即出现核仁TDP-43荧光强度降低35%,6周时核TDP-43也显著减少。使用C端抗体(12892-1-AP)验证核仁TDP-43为C端截短亚型。
【核仁结构异常】
Fibrillarin标记显示Elp CKO小鼠核仁面积减少28%,荧光强度降低42%,表明Elongator缺失引发核仁应激。这与ALS患者中观察到的核仁病理特征高度一致。
这项研究的重要发现在于:首次在动物模型中证实Elongator功能障碍直接导致TDP-43从运动神经元核仁清除,将两个独立的ALS病理特征(核仁应激与TDP-43异常)通过分子机制联系起来。研究还揭示了抗原修复步骤会掩盖TDP-43核仁定位这一技术细节,解释了为何该现象在既往文献中较少报道。这些发现为理解散发性ALS的发病机制提供了新视角,提示靶向Elongator-TDP-43-核仁轴可能成为治疗策略的新方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘