
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向癌症相关成纤维细胞驱动的LIF/LIFR轴增强吉西他滨联合白蛋白结合型紫杉醇治疗胰腺癌的疗效
【字体: 大 中 小 】 时间:2025年08月23日 来源:npj Precision Oncology 8
编辑推荐:
胰腺导管腺癌(PDAC)因肿瘤微环境(TME)中癌细胞与基质的交互作用导致治疗耐药。本研究通过靶向LIF/LIFR轴开发新型小分子抑制剂EC359,在PDAC细胞与癌症相关成纤维细胞(CAFs)共植入模型中将肿瘤负荷降低90%,联合吉西他滨(Gem)显著抑制STAT3信号通路并改善免疫微环境,为克服PDAC治疗耐药提供新策略。
胰腺导管腺癌(PDAC)被称为"癌症之王",其5年生存率仅为13%,治疗困境主要源于独特的肿瘤微环境(TME)中癌症相关成纤维细胞(CAFs)与肿瘤细胞的复杂交互。CAFs通过分泌白血病抑制因子(LIF)等细胞因子激活LIF受体(LIFR)介导的STAT3信号通路,不仅促进肿瘤干细胞特性,还形成物理屏障阻碍化疗药物递送。虽然靶向LIF的单克隆抗体已进入临床试验,但抗体药物在高度纤维化的PDAC中渗透性受限,且无法阻断LIFR的其他配体激活。这项发表在《npj Precision Oncology》的研究创新性地开发了小分子抑制剂EC359,系统解决了PDAC治疗中的基质屏障和信号通路激活双重难题。
研究团队采用患者来源CAFs与PDAC细胞共培养模型、KPC基因工程小鼠(KrasG12D;Trp53R172H;Pdx1-cre)等实验体系,结合RNA测序和流式细胞术等技术。
EC359抑制CAF介导的STAT3信号激活
研究发现CAFs高表达LIF,通过条件培养基激活PDAC细胞中STAT3(Y705)磷酸化。EC359以剂量依赖性方式阻断这一过程,2.5μM浓度即可显著抑制pSTAT3水平。
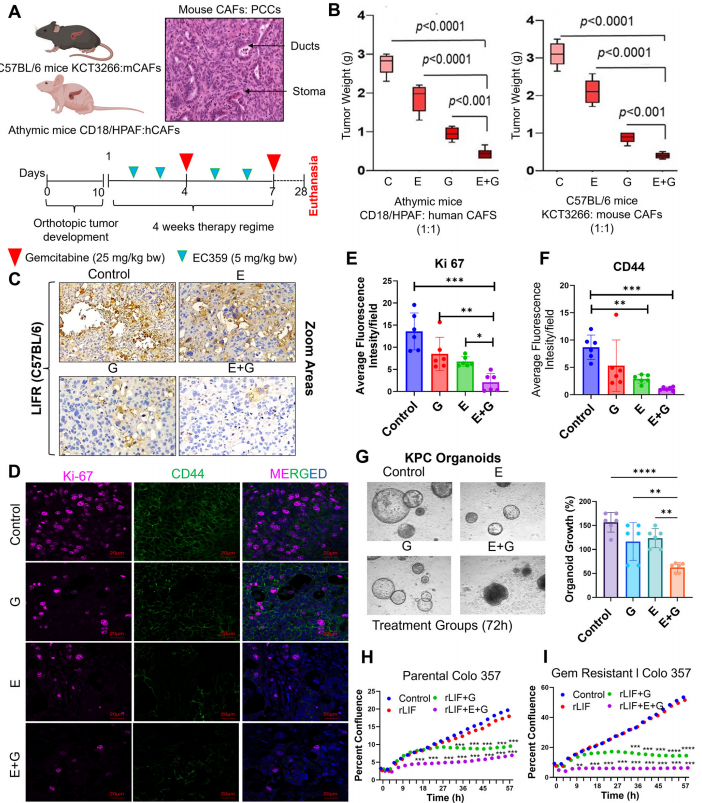
EC359增强吉西他滨治疗效果
在CAFs与PDAC细胞(1:1)共植入模型中,EC359(5mg/kg)联合吉西他滨使肿瘤负荷降低55%(相比单药)和90%(相比对照)。机制上:
下调干细胞标志物CD44表达
使吉西他滨耐药细胞Colo357恢复敏感性
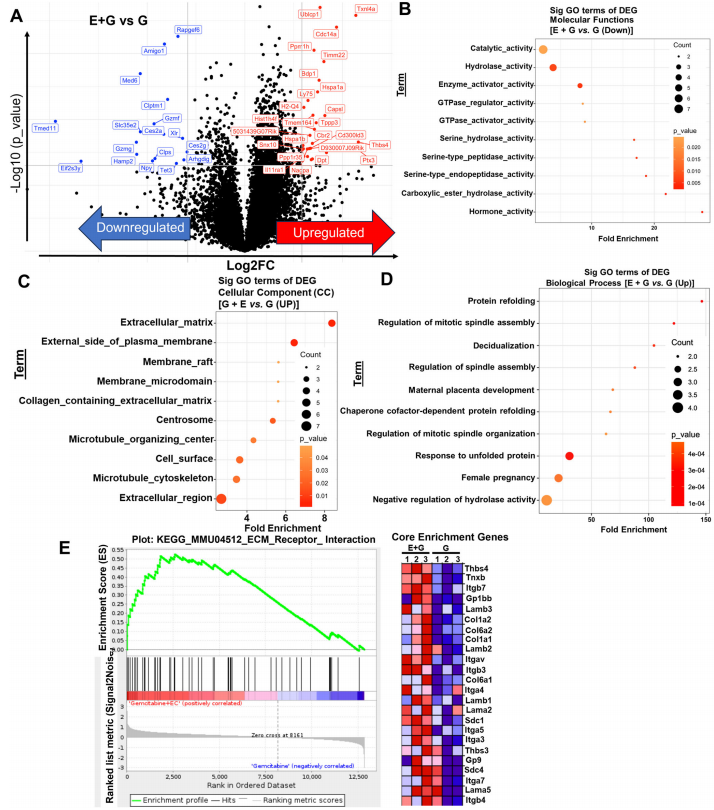
RNA测序显示EC359调控细胞外基质(ECM)重构和微管组装
EC359协同化疗药物机制
EC359通过双重机制增强化疗效果:
与白蛋白结合型紫杉醇协同稳定微管结构(α-tubulin束增加2.3倍)
上调核苷转运蛋白ENT1表达,促进吉西他滨摄入
KPC模型验证临床转化价值
在25-30周龄KPC小鼠中,EC359联合吉西他滨/白蛋白结合型紫杉醇(G+A)方案:
肿瘤重量显著减轻
增加树突状细胞(CD86+ DC)浸润
降低调节性T细胞(T-reg)比例
纤维连接蛋白(FN1)表达减少
该研究首次证实小分子LIFR抑制剂EC359通过多靶点作用:
阻断CAF-PCC旁分泌环路
抑制STAT3依赖的干细胞特性
重塑免疫抑制性微环境
增强微管稳定性克服化疗耐药
临床转化方面,EC359作为口服小分子药物具有更好的肿瘤渗透性,且能同时阻断LIFR的多种配体激活,相比单抗药物具有独特优势。该研究为PDAC的联合治疗提供了新范式,相关发现已推动EC359进入临床前开发阶段。
 生物通微信公众号
生物通微信公众号
知名企业招聘