
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:细菌介导的双链RNA递送技术在蚊媒病毒防控中的应用
【字体: 大 中 小 】 时间:2025年08月23日 来源:TRENDS IN Parasitology 6.6
编辑推荐:
这篇综述创新性地探讨了利用工程化细菌共生体递送双链RNA(dsRNA)靶向蚊媒病毒及其宿主的基因沉默策略,为应对登革热(DENV)、寨卡(ZIKV)等虫媒病毒(arboviruses)的传播提供了可持续防控方案。作者系统分析了RNA干扰(RNAi)通路在蚊虫中的抗病毒机制、细菌-宿主互作动态及合成生物学工具的应用潜力,并指出优化dsRNA递送效率与系统性RNAi(systemic RNAi)响应是未来研究的关键。
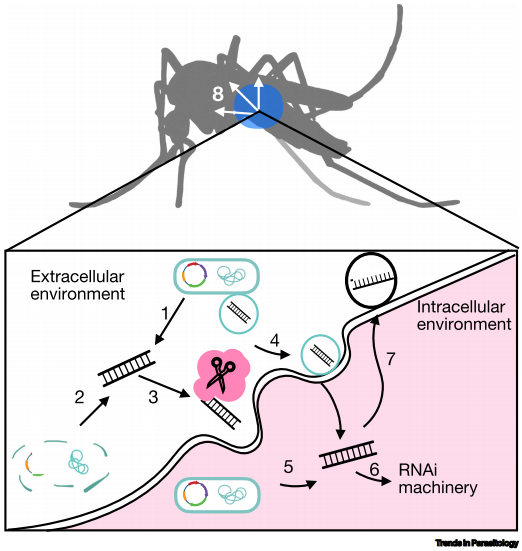
蚊媒病毒如寨卡、登革热和基孔肯雅病毒(CHIKV)通过蚊虫传播,其扩散受气候变暖和城市化影响加剧。RNA干扰(RNAi)作为昆虫天然的抗病毒机制,可通过双链RNA(dsRNA)触发序列特异性基因沉默,既能靶向蚊虫发育关键基因以降低种群密度,又能直接抑制病毒复制。然而,当前dsRNA递送方法存在成本高、效果短暂等问题,限制了其应用。
工程化细菌共生体为dsRNA递送提供了新思路。与短暂定植的大肠杆菌HT115不同,天然共生菌如按蚊体内的Serratia fonticola经RNase III基因敲除后,可稳定表达dsRNA并诱导幼虫发育基因EcR和Met沉默,导致高死亡率。但针对病毒基因组(如CHIKV衣壳蛋白)的细菌递送效果却不及体外转录dsRNA注射,暗示递送机制与系统性RNAi响应效率存在物种特异性差异。
dsRNA的沉默效率受多重因素影响:
结构特性:长链dsRNA(200-500 bp)比短链(21 bp)更易被细胞摄取,而"回形针"结构可通过网格蛋白非依赖途径进入埃及伊蚊细胞。
靶标选择:针对黄病毒(flaviviruses)非结构蛋白NS3或甲病毒(alphaviruses)衣壳蛋白的dsRNA均能有效抑制病毒复制,但布尼亚病毒(bunyaviruses)NSs靶向效果较差,可能与病毒衍生siRNA(vsiRNA)生成偏好有关。
递送载体:胞外囊泡(BEVs)或胞内共生菌(如定植中肠的Rosenberggiella-YN46)可保护dsRNA免受核酸酶降解,但不同菌种的囊泡分泌效率与宿主细胞入侵能力差异显著。
成功应用需平衡三重要素:
组织嗜性:中肠定植菌(如Serratia AS1)适合靶向吸血后复制的病毒,而血淋巴扩散菌可激活系统性RNAi。
基因回路设计:利用血餐诱导型启动子(如Asaia菌的pHSP70)可降低共生体代谢负担。
抗性管理:组合靶向蚊虫生殖基因和病毒保守区(如DENV NS4A)能延缓抗性进化。值得注意的是,某些共生菌(如Chromobacterium)本身具有抗病毒特性,需避免工程化改造削弱其天然功能。
当前技术已实现:
广宿主质粒:在Pantoea agglomerans中表达抗疟效应蛋白
染色体整合:CRISPR/Cas9敲除Cedecea neteri的ampA基因
条件性表达:Tn7转座子系统在Asaia SF2.1中稳定整合报告基因
新兴的CAST(CRISPR相关转座酶)系统为多基因模块(如dsRNA+定植因子)的同步递送提供了可能。
亟待解决的核心问题包括:
蚊虫系统性RNAi的传播机制是否依赖病毒DNA(vDNA)合成?
胞外囊泡递送dsRNA的效率是否受PIWI蛋白(如Piwi4)调控?
如何通过 phage-mediated 技术改造不可培养共生菌?
这些突破将推动细菌介导RNAi从实验室走向田间应用,为虫媒病毒防控提供精准化解决方案。
 生物通微信公众号
生物通微信公众号
知名企业招聘