
-

生物通官微
陪你抓住生命科技
跳动的脉搏
钙化性主动脉瓣疾病通过细胞外囊泡miR-145-5p调控瓣膜间质细胞钙化的机制研究
【字体: 大 中 小 】 时间:2025年08月24日 来源:Basic Research in Cardiology 8
编辑推荐:
本研究针对钙化性主动脉瓣疾病(CAVD)缺乏有效药物治疗的临床难题,通过多组学分析发现细胞外囊泡(EV)携带的miR-145-5p在患者和动物模型中显著上调。研究人员揭示了miR-145-5p通过ZEB2-ALPL轴促进瓣膜间质细胞(VICs)钙化的新机制,为CAVD的早期诊断和治疗提供了潜在靶点。该成果发表于《Basic Research in Cardiology》。
在全球老龄化加剧的背景下,钙化性主动脉瓣疾病(CAVD)已成为威胁老年人健康的重要杀手。这种被称为"心脏阀门生锈"的疾病,每年导致数百万人需要进行主动脉瓣置换手术。令人担忧的是,目前临床上没有任何药物能够阻止或逆转瓣膜的钙化进程,当患者出现心绞痛、晕厥等症状时,两年内死亡率高达50%以上。更棘手的是,传统观点认为CAVD是简单的"磨损"过程,但最新研究揭示这是一个涉及慢性炎症、细胞凋亡和异常钙化的复杂病理过程。
面对这一临床困境,P.R.Goody和D.Christmann等研究者将目光投向了细胞间通讯的关键信使——细胞外囊泡(EVs)及其携带的微小RNA(miRNA)。这些纳米级的"分子快递"如何在瓣膜细胞间传递致病信号?又是哪些关键分子驱动了瓣膜的钙化进程?这些问题成为破解CAVD治疗难题的重要突破口。
研究人员采用多中心合作模式,整合临床样本分析与基础实验验证。关键技术包括:从接受主动脉瓣置换术(SAVR)的患者中获取钙化和非钙化瓣膜组织建立样本队列;建立小鼠主动脉瓣狭窄(AVS)模型进行体内验证;通过miRNA芯片和RNA测序进行组学分析;采用磁珠分选技术(MACS)分离瓣膜内皮细胞(VECs)和间质细胞(VICs);利用纳米颗粒追踪分析(NTA)和透射电镜(TEM)表征细胞外囊泡;开展体外钙化实验评估miR-145-5p功能。
研究结果部分揭示了系列重要发现:
基线特征和差异表达miRNA鉴定
通过对54例SAVR患者(37例CAVD,17例对照)的临床分析发现,CAVD患者糖尿病、高血压等心血管风险因素显著增高。miRNA芯片筛选鉴定出12个差异表达miRNA,其中miR-145-5p在CAVD组织中上调超过3倍(p=0.001),且与钙化程度显著相关(r=-0.253)。ROC曲线分析显示其诊断价值突出(AUC=0.780)。
人和小鼠CAVD模型中miR-145-5p上调
小鼠wire injury模型成功模拟人类CAVD病理特征,表现为胶原沉积增加、血流速度加快和射血分数下降。值得注意的是,miR-145-5p在人和小鼠病变瓣膜中均显著上调,显示出跨物种保守性。
瓣膜细胞特异性表达分析
建立的改进型MAC分选方案成功分离患者源性VICs和VECs。qRT-PCR证实miR-145-5p在VICs中的表达量显著高于VECs,提示其可能通过间质细胞参与钙化调控。
EV-miR-145-5p的转运机制
大型EVs(170-800nm)是miR-145-5p的主要载体,能抵抗RNA酶降解。共培养实验和荧光标记证实EVs可将miR-145-5p转运至受体VICs,实现细胞间通讯。
miR-145-5p调控钙化的分子机制
体外钙化实验显示miR-145-5p上调碱性磷酸酶(ALPL)等成骨标志物。机制上,miR-145-5p通过结合ZEB2的3'UTR抑制其表达,解除ZEB2对ALPL的转录抑制,从而促进钙化。转录因子活性分析发现NFκB、STAT等信号通路参与调控。
组学分析验证
RNA测序证实钙化VICs中ALPL、RUNX2等基因上调。miRNA测序再确认miR-145-5p的关键作用。KEGG分析显示骨生成和凋亡通路显著富集。
这项研究首次系统阐明了EV-miR-145-5p/ZEB2/ALPL轴在CAVD中的核心作用。从临床角度看,循环EV-miR-145-5p有望成为CAVD早期诊断标志物;从治疗角度看,靶向干预该通路可能延缓甚至阻止瓣膜钙化进程。研究创新性地揭示了细胞间囊泡通讯在瓣膜疾病中的重要性,为开发"分子手术刀"式的精准治疗策略奠定了理论基础。
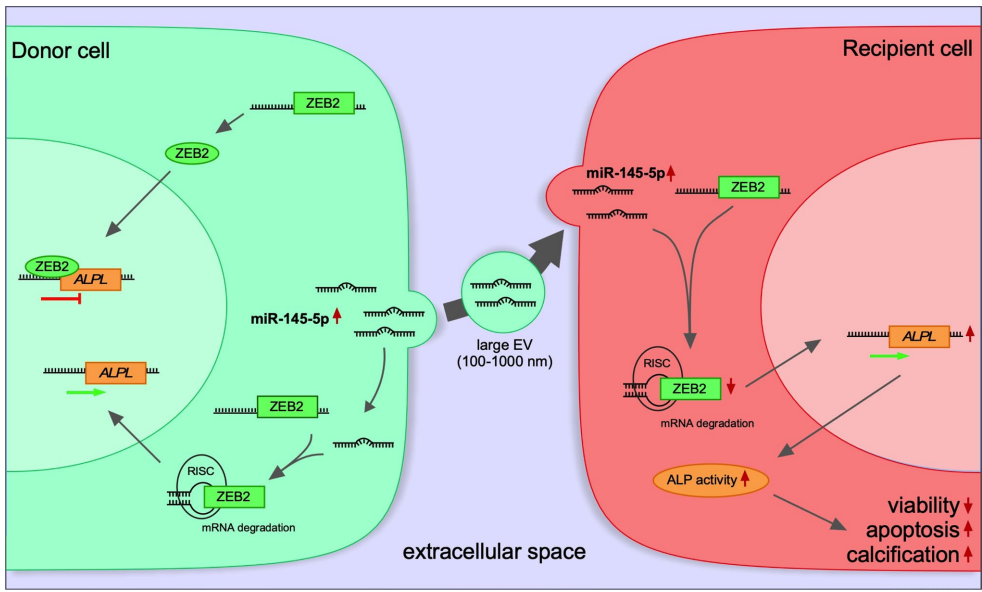
特别值得关注的是,该研究建立的"临床发现-动物验证-机制解析"研究范式,为其他瓣膜疾病研究提供了可借鉴的方法学框架。研究者不仅发现了miR-145-5p这一关键分子,更阐明了其从产生(EV包装)、转运(细胞间传递)到发挥作用(ZEB2-ALPL轴)的完整链条,这种系统性研究思路对复杂疾病机制解析具有重要启示意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘