
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:DUX4问世25周年:从“垃圾DNA”到面肩肱型肌营养不良症致病基因的蜕变之路
【字体: 大 中 小 】 时间:2025年08月26日 来源:Skeletal Muscle 4.4
编辑推荐:
这篇里程碑式综述系统梳理了DUX4基因的发现历程,从最初被视为FSHD(面肩肱型肌营养不良症)4q35位点的"垃圾DNA",到被确认为调控合子基因组激活(ZGA)的关键转录因子,最终成为FSHD1/2型共同致病机制的核心分子。文章通过三大关键突破——DUX4基因鉴定(1999)、细胞毒性验证(2007)及poly(A)信号(PAS)发现(2010),揭示了DUX4通过异常激活胚胎转录程序导致肌细胞损伤的分子病理机制,为靶向治疗提供了理论依据。
DUX4基因的崛起始于对面肩肱型肌营养不良症(FSHD)致病机制的探索。作为第三大常见遗传性肌营养不良症,FSHD临床表现为进行性面部、肩胛带和上肢肌无力,具有显著的临床异质性。1990年代遗传连锁研究将FSHD基因座定位于4q35,随后发现该区域存在D4Z4串联重复序列的拷贝数变异——健康人群通常携带11-100个D4Z4单元,而FSHD患者仅保留1-10个。
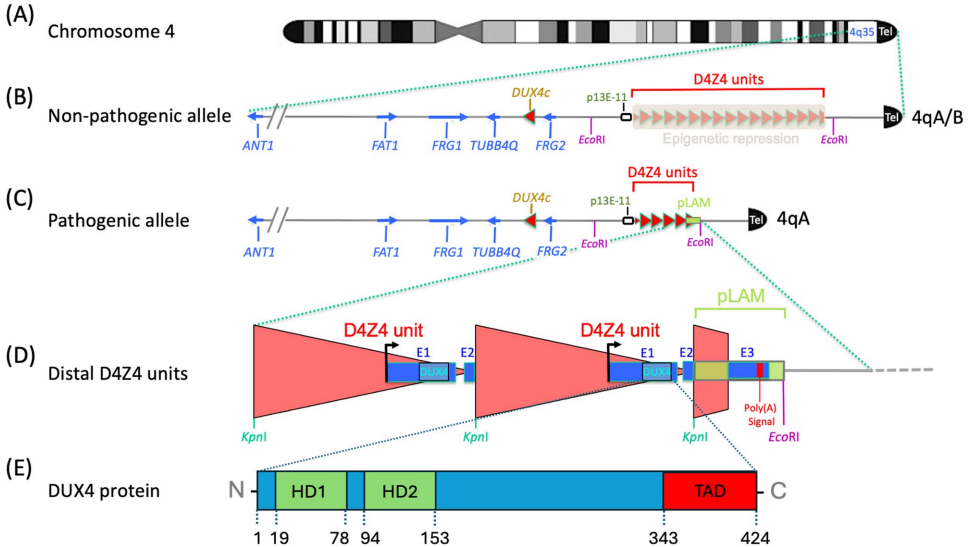
19世纪中叶Landouzy和Dejerine首次描述FSHD的典型肌萎缩模式,20世纪后期Padberg等通过大家系研究确认其常染色体显性遗传特征。1992年突破性发现p13E-11探针可检测4q35特异的EcoRI限制性片段,揭示D4Z4重复单元长度为3.3kb,每个单元包含双同源盒结构。值得注意的是,DUX4基因完整编码序列就隐藏在这些曾被视作"垃圾DNA"的重复元件中。
1999年Belayew团队首次在D4Z4单元中发现功能性启动子和DUX4开放阅读框,该基因编码含两个同源结构域(HD1/HD2)的转录因子。但当时学界普遍质疑其生物学功能,原因有三:缺乏内含子、未发现典型poly(A)信号、以及难以在体细胞中检测到表达。2007年关键实验证明DUX4蛋白具有剂量依赖性细胞毒性,能诱导肌细胞凋亡并破坏分化进程,为"功能获得性"致病假说提供直接证据。
2010年van der Maarel团队揭示4qA单倍型的关键作用——其特有的ATTAAA poly(A)信号可稳定DUX4 mRNA。在FSHD中,D4Z4阵列缩短(FSHD1)或SMCHD1等表观调控因子突变(FSHD2)导致染色质松弛,使远端D4Z4单元中的DUX4逃脱表观沉默。异常表达的DUX4作为先锋转录因子,通过以下途径引发病理改变:
激活胚胎特异性基因(如ZSCAN4、TRIM43)
解除内源性逆转录病毒(ERV)沉默
干扰PAX7介导的肌生成程序
诱导线粒体功能障碍和氧化应激
2017年三项独立研究揭示DUX4在进化中的保守性源于其对合子基因组激活的调控作用。在人类胚胎4-8细胞期,DUX4短暂高表达激活次要ZGA波,随后被SMCHD1介导的表观沉默永久关闭。FSHD中DUX4的异位表达重新激活这一胚胎程序,导致:
肌管核内HSATII双链RNA聚集
DNA损伤应答缺陷
干扰素信号通路抑制(通过STAT1相互作用)
激素受体共抑制(通过LXXLL基序)
当前靶向DUX4的治疗方案包括反义寡核苷酸(ASO)、小分子抑制剂(如p300/CBP抑制剂)和基因编辑。但核心挑战在于DUX4的罕见表达模式(仅0.1%肌核阳性)和种系保护需求。遗留的科学问题包括:
4qA携带者外显率不足5%的调控机制
睾丸/胸腺等组织基础表达的生理意义
DUX4与DUX4c的功能拮抗关系
性别差异(雌激素拮抗效应)的分子基础
该综述通过25年的研究历程,完美诠释了"垃圾DNA"如何蜕变为关键致病因子,为表观遗传失调疾病研究提供了经典范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘