
-

生物通官微
陪你抓住生命科技
跳动的脉搏
细胞游离合成全长人β1肾上腺素受体与Gs蛋白复合物的冷冻电镜结构解析及其信号调控机制研究
【字体: 大 中 小 】 时间:2025年08月26日 来源:Structure 4.3
编辑推荐:
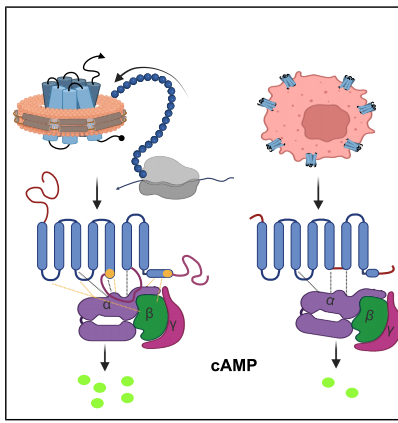
本研究通过创新的细胞游离表达系统,成功制备了包含完整第三胞内环(ICL3)的全长人β1肾上腺素受体(HFLβ1AR)与Gs异源三聚体复合物,并利用冷冻电镜技术首次解析了3.3?分辨率的三维结构。该研究揭示了ICL3通过延伸TM5螺旋形成扩展的GPCR/G蛋白界面,阐明了其增强cAMP信号传导的结构基础,为开发靶向GPCR变构位点的新型药物提供了重要理论依据。
在药物研发领域,G蛋白偶联受体(GPCR)家族一直是"明星靶点",其中β1肾上腺素受体(β1AR)作为心血管疾病治疗的重要靶标备受关注。然而长期以来,结构生物学研究面临一个关键瓶颈:为了获得稳定的重组蛋白,研究人员不得不截去受体中高度动态的第三胞内环(ICL3)和末端结构域,这些改造虽然解决了技术难题,却可能掩盖了受体天然构象的重要特征。特别是ICL3区域,虽然已知其能显著增强Gs蛋白偶联效率,但由于结构柔性,在所有已解析的β1AR结构中均被截短,导致其分子机制成为未解之谜。
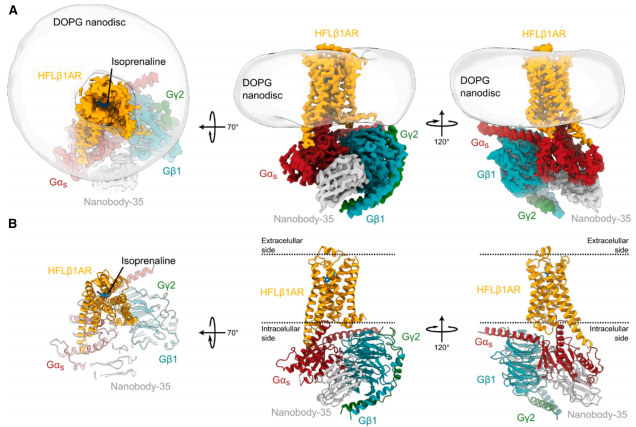
为突破这一限制,Felipe Merino等研究者创新性地采用大肠杆菌裂解物体外无细胞(CF)表达系统,将全长人β1AR共翻译插入纳米盘(ND)膜环境,成功制备了包含完整ICL3的受体与Gs蛋白复合物。这项发表在《Structure》的研究,通过冷冻电镜技术首次捕获了激动剂isoprenaline结合状态下全长受体的精细结构,分辨率达到3.3?,揭示了ICL3调控信号传导的分子机制。
研究团队运用了多项关键技术:1)利用大肠杆菌A19菌株制备高效CF表达系统;2)共翻译将受体插入DOPG脂质纳米盘形成天然膜环境;3)体外重组Gs异源三聚体蛋白;4)冷冻电镜单颗粒分析技术解析复合物结构;5)基于CAMYEL生物传感器的cAMP信号检测系统验证功能。实验设计巧妙地将细胞生物学、结构生物学和生物化学方法相结合,克服了全长GPCR结构解析的传统难题。
研究结果部分包含以下重要发现:
"Cryo-EM structure of the isoprenaline-bound HFLβ1AR-Gs complex in nanodiscs":结构显示HFLβ1AR与Gs形成1,427?2的扩展界面,显著大于截短受体(1,073-1,103?2)。ICL3的N端五残基(C261ICL3-F265ICL3)形成α螺旋延伸TM5,使螺旋长度增加3圈。
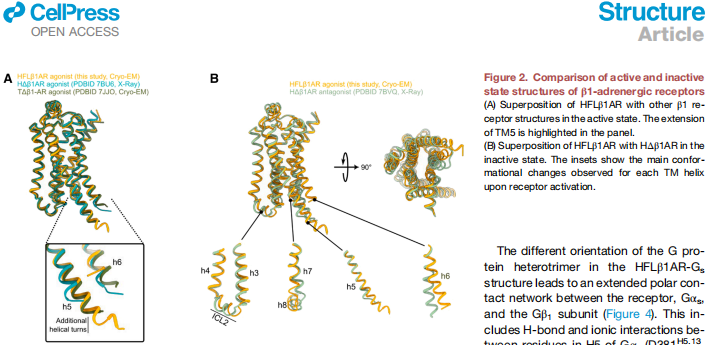
"Structural comparison of the HFLβ1AR-Gs complex with other active and inactive state β1AR structures":与截短受体相比,延伸的TM5呈现弯曲构象,使Q2545x68向TM6靠近5?,形成新的极性相互作用网络。
"HFLβ1AR ICL3 enhances the GPCR/G protein interface":R263ICL3/R264ICL3与Gαs的hgh4环形成离子键,F265ICL3与H4疏水相互作用,这些在截短结构中完全缺失。
"Mutational analysis of the extended HFLβ1AR-Gs protein-coupling interface":功能实验显示,删除ICL3和C端使EC50增加130倍;关键残基突变(R263A/R264A/F265A)使效力降低60倍,证实扩展界面增强信号传导。
讨论部分强调了该研究的三大突破:首先,CF表达结合ND技术为全长GPCR结构研究提供了新范式,避免了传统方法必需的截短改造。其次,结构揭示了ICL3通过"双机制"增强信号:直接参与Gαs结合,同时诱导G蛋白整体旋转形成额外相互作用。最后,发现Gβ亚基与ICL1/H8的新接触,为理解GPCR-G蛋白特异性偶联提供了结构基础。
这项研究不仅解决了β1AR领域长期存在的结构生物学问题,其技术路线更为其他含长环GPCR的结构解析提供了借鉴。从转化医学角度看,ICL3与G蛋白的精细互作
 生物通微信公众号
生物通微信公众号
知名企业招聘