
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Tri-snRNP活性调控tau蛋白病变表型:从线虫模型到阿尔茨海默病的人类证据
【字体: 大 中 小 】 时间:2025年08月26日 来源:NAR Molecular Medicine
编辑推荐:
本研究通过线虫模型发现spliceosome(剪接体)核心组分DIB-1/TXNL4A的突变可改善tau蛋白病变,揭示U4/U6.U5 tri-snRNP(三小核糖核蛋白复合体)活性调节tau毒性新机制。研究发现dib-1 S2L突变通过诱导广泛intron retention(内含子滞留)和NMD(无义介导的mRNA降解)通路改变tau蛋白稳态,并在AD患者脑组织中发现TXNL4A和PRP8表达下降。该研究为tauopathy(tau蛋白病变)治疗提供了新的分子靶点。
在神经退行性疾病研究领域,tau蛋白异常聚集形成的神经原纤维缠结是阿尔茨海默病(AD)等tau蛋白病变的核心病理特征。尽管已知tau蛋白从微管解离后会发生病理性聚集,但驱动这一过程的具体分子机制仍不明确。更关键的是,目前尚缺乏有效干预tau毒性的治疗靶点。这一科学难题促使Katherine R. LeBlanc等研究者将目光投向了一个意想不到的方向——mRNA剪接机制。
研究人员利用经典的线虫遗传学方法,在表达人类tau蛋白的Caenorhabditis elegans模型中展开研究。这种体长仅1毫米的透明线虫具有完整的神经系统和快速衰老特性,能重现人类tau病变的关键特征:年龄依赖性磷酸化tau积累、tau聚集、神经元功能障碍和退化。通过正向遗传筛选,研究者发现了一个令人惊讶的tau毒性抑制因子——剪接体核心组分DIB-1/TXNL4A。
主要技术方法包括:1) 线虫行为学分析(WormTracker系统定量运动缺陷);2) CRISPR-Cas9基因编辑构建dib-1突变体;3) 免疫印迹分析tau蛋白水平及磷酸化状态;4) RNA测序解析剪接变化;5) 人类死后脑组织免疫组化分析TXNL4A和PRP8表达;6) 神经退行性变定量(荧光标记GABA能神经元计数)。
Mutations in dib-1 ameliorate tau-driven behavioral deficits
研究发现dib-1基因的S2L点突变能显著改善tau转基因线虫的运动缺陷。通过CRISPR重建的dib-1 S2L突变体在表达野生型和突变型(V337M)tau的线虫中都表现出运动功能恢复。值得注意的是,野生型DIB-1过表达会加剧tau毒性,而突变型DIB-1过表达则产生保护作用,提示S2L突变导致功能缺失。
Mutations in dib-1 decrease total and phosphorylated tau, neurodegeneration, and lifespan defects in tau transgenic C. elegans
免疫印迹分析显示dib-1突变使总tau蛋白及S202和S396/404位点磷酸化tau水平降低50%以上。这种变化并非源于mRNA水平改变。神经退行性变分析表明,dib-1 S2L突变挽救了tau导致的GABA能神经元丢失。寿命实验进一步证实dib-1突变能部分逆转tau转基因线虫的寿命缩短。
dib-1 mutation drives broad changes in splicing
RNA测序揭示dib-1突变导致368个基因发生413个剪接事件改变,其中70%以上是可能触发NMD的内含子滞留。引人注目的是,tri-snRNP另一组分PRP-8的杂合缺失也能改善tau毒性,但不影响tau蛋白水平,表明tri-snRNP功能整体下调可能对抗tau病变。
Disruption of non-sense mediated decay enhances dib-1 rescue
在smg-2(核心NMD因子)敲除背景下,dib-1 S2L突变对tau毒性的改善作用进一步增强,提示特定内含子滞留转录本的积累可能在保护机制中起关键作用。这些基因显著富集于转录调控、寿命调节和DNA修复等通路。
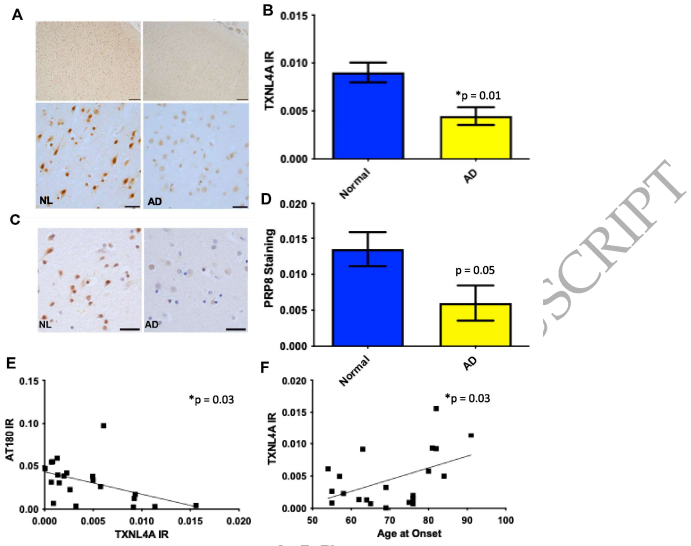
TXNL4A and PRP8 levels are decreased in human AD
人类脑组织分析显示,AD患者额叶皮层TXNL4A水平显著降低,且TXNL4A水平与磷酸化tau负担呈负相关。有趣的是,TXNL4A较高者AD发病年龄较晚。tri-snRNP另一核心组分PRP8在AD中同样减少,而其他核斑蛋白如ALYREF无此变化。
这项发表于《NAR Molecular Medicine》的研究具有多重重要意义:首先,揭示了剪接体功能与tau蛋白病变之间前所未有的联系,证明tri-snRNP活性调节可作为tau毒性干预的新靶点。其次,发现内含子滞留和NMD通路在tau蛋白稳态调控中的关键作用,为理解tau-RNA相互作用提供了新视角。最后,人类AD脑中TXNL4A和PRP8的减少及其与疾病严重度的相关性,凸显了这一机制的临床相关性。
研究提出的"核斑蛋白耗竭假说"特别值得关注——与先前发现的MSUT2、PABPN1等核斑蛋白类似,TXNL4A在严重AD病例中的减少可能反映了一种幸存者偏差,即高表达这些蛋白的神经元更易在tau病理中存活。这一发现为开发基于剪接调节的神经保护策略奠定了理论基础,也为理解tau介导的RNA代谢紊乱开辟了新途径。
 生物通微信公众号
生物通微信公众号
知名企业招聘