
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:保留射血分数心力衰竭的临床前模型:基于器械治疗的认知进展
【字体: 大 中 小 】 时间:2025年08月27日 来源:Annals of Biomedical Engineering 5.4
编辑推荐:
这篇综述系统梳理了保留射血分数心力衰竭(HFpEF)的临床前模型研究进展。文章详细分析了计算机模拟(in-silico)、体外(in-vitro)、离体(ex-vivo)和体内(in-vivo)四类模型在模拟HFpEF病理特征(如左房压升高、心室僵硬度增加)方面的优劣,强调了这些模型对开发新型器械疗法(如心房分流装置、左室扩张器)的重要指导价值。特别指出多尺度建模和人工智能等新兴技术将推动个性化治疗发展。
保留射血分数心力衰竭(HFpEF)的模型革命
引言
全球约6400万心衰患者中,半数为HFpEF——这种以心室僵硬但射血分数正常为特征的疾病,五年死亡率高达47%,治疗效果却远逊于射血分数降低型心衰(HFrEF)。随着钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂成为主要药物疗法,器械治疗的发展迎来新机遇。然而,患者的高度异质性使得器械研发面临巨大挑战,这凸显了临床前模型的关键价值。
模型全景图
当前HFpEF模型可分为四大阵营:计算机模拟(in-silico)模型通过电路类比模拟血流动力学;体外(in-vitro)模型用机械循环回路重现生理条件;离体(ex-vivo)模型将生物心脏接入人工循环系统;体内(in-vivo)动物模型则完整保留神经体液调节。如图1所示,这些模型在复杂度、保真度、成本等方面各具特色,形成从基础研究到临床转化的完整链条。
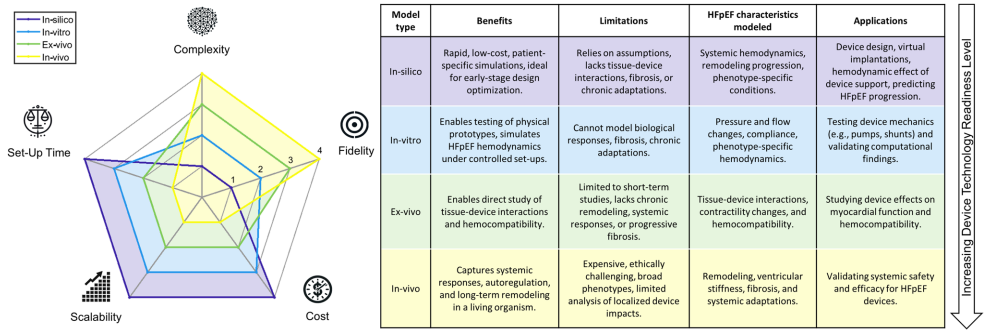
计算机模拟的智慧结晶
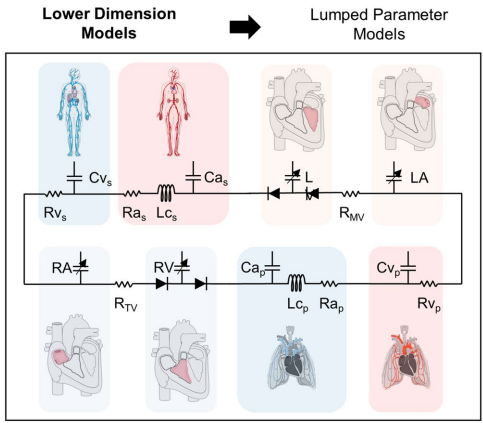
集总参数模型(LPM)如同"数字心脏",通过调节电阻电容元件成功模拟了HFpEF患者运动时左房压骤升11 mmHg的特征。Burkhoff团队利用该模型比较四种HFpEF表型对左房辅助装置的反应,发现心肌淀粉样变患者最易发生心室吸吮现象。而有限元模型(FEM)则能展现心肌纤维层面的应力分布,Genet开发的生长模型首次实现了从数月到数年时间尺度的病理性重构预测。
多尺度模型的突破尤为亮眼。Ozturk团队将LPM与三维FEM耦合,清晰呈现主动脉瓣狭窄导致的心室壁应力重分布(图2)。这种"从芯片到器官"的整合,为脉冲式心室辅助装置的优化提供了独特视角——模拟显示其降低左房压的效果比连续流装置高23%。
体外模型的精密仿真
Mock循环回路(MCL)堪称"机械心脏",Langer团队用气动驱动的心室腔成功复现了HFpEF患者运动耐量下降的特征。特别设计的"高血压模块"通过调节外周阻力,使系统血管阻力指数(SVRI)精确匹配临床数据。而Malone开发的患者特异性软体心室模型,采用3D打印技术还原了真实心脏的几何特征,在测试经导管主动脉瓣时发现尺寸偏差5%就会导致显著瓣周漏。
离体心脏的生物学窗口
Escher设计的离体猪心-循环系统复合体(图3)展现了生物组织的独特价值:当CoPulse装置以60次/分钟工作时,心肌氧耗量降低18%,这为评估器械的"心肌节能效应"提供了直接证据。不过,这类模型难以模拟慢性病变特征——健康心脏接入系统后虽出现舒张功能异常,但无法重现HFpEF典型的间质纤维化改变。
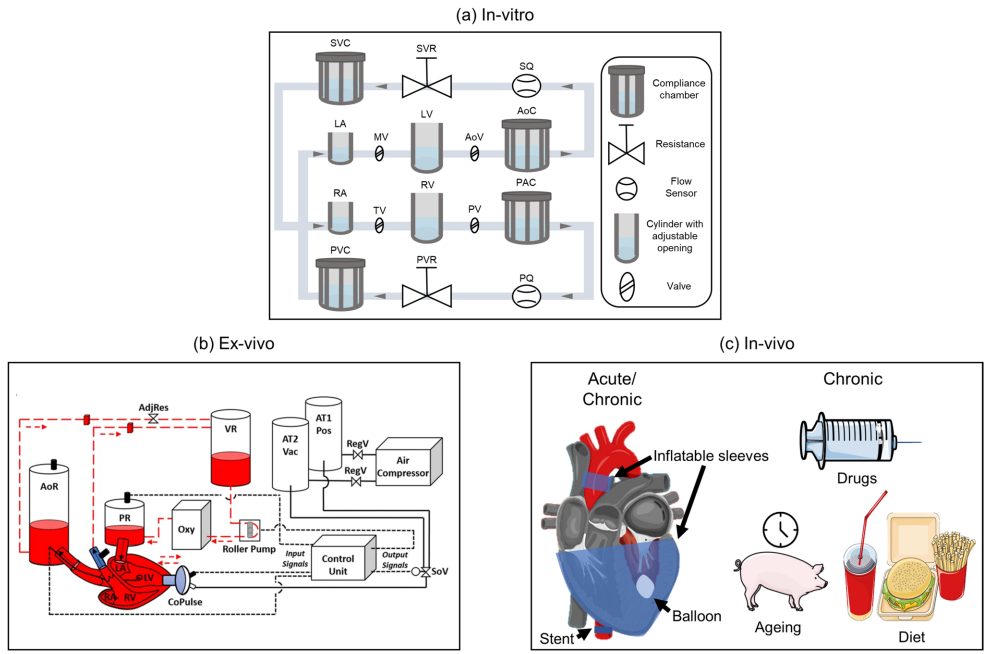
动物模型的在体验证
主动脉环扎术建立的慢性猪模型最具临床相关性:术后8周,左室质量指数增加35%,心肌胶原含量翻倍,完美模拟人类HFpEF的病理重塑。而Schwarzl团队开发的DOCA-高脂饮食模型则再现了代谢异常与心衰的恶性循环——这类动物在多巴酚丁胺应激下表现出与患者相似的收缩储备受损。
未来之路
人工智能驱动的"数字孪生"技术正掀起革命。通过融合百万例临床数据,虚拟患者模型可预测特定器械对不同HFpEF表型的响应。而器官芯片技术结合3D生物打印,有望在微流控系统中重建患者特异性心肌纤维化模式。这些创新将大幅减少动物实验需求,加速个性化器械的研发进程。
结语
从电路模拟到基因编辑动物,HFpEF模型的发展史正是一部医学工程学的进化史。尽管尚无单一模型能完美复现这种复杂疾病,但多层次模型的整合应用已为突破性疗法的诞生铺平道路。随着跨学科技术的深度融合,攻克HFpEF的"终极武器"或许就藏在这些精妙的模型之中。
 生物通微信公众号
生物通微信公众号
知名企业招聘