
-

生物通官微
陪你抓住生命科技
跳动的脉搏
化疗药物激活AEP切割G3BP1调控骨肉瘤中应激颗粒/核仁/线粒体互作的新机制
【字体: 大 中 小 】 时间:2025年08月27日 来源:Bone Research 15
编辑推荐:
本研究针对骨肉瘤(OS)化疗耐药难题,揭示了化疗药物通过激活天冬酰胺内肽酶(AEP)特异性切割应激颗粒(SGs)核心蛋白G3BP1,产生tG3BP1-Ns和tG3BP1-Cs片段,分别调控SG动态平衡、核仁mRNA翻译抑制及线粒体氧化应激缓解的协同机制。该发现为OS及恶性胶质瘤的化疗增敏提供了新靶点(AEP/G3BP1),相关成果发表于《Bone Research》。
骨肉瘤(OS)作为最常见的原发性骨恶性肿瘤,长期困扰着儿童和青少年患者群体。尽管手术联合化疗已显著改善患者生存,但近三十年来疗效进入平台期,耐药复发成为临床痛点。有趣的是,应激颗粒(stress granules, SGs)——这些由RNA-蛋白质复合物组成的无膜细胞器,已被证实在肿瘤应激响应中扮演关键角色。然而,化疗药物如何通过SGs与核仁、线粒体等细胞器对话来促进肿瘤存活的机制始终成谜。
上海交通大学医学院团队在《Bone Research》发表的研究,首次揭示了化疗药物通过激活天冬酰胺内肽酶(asparagine endopeptidase, AEP)特异性切割SG支架蛋白G3BP1,产生具有不同功能的蛋白片段,形成"三位一体"的细胞器协同防御网络。这一发现不仅解释了OS和恶性胶质瘤的化疗耐药机制,更为靶向干预提供了精确的分子靶点。
关键技术方法
研究采用化疗药物(顺铂/阿霉素)处理骨肉瘤(U2OS、143B)和胶质瘤(U87-MG)细胞系,通过免疫荧光追踪SG动态;利用PAR-CLIP测序和RNA免疫共沉淀(RIP-qPCR)解析tG3BP1-Cs的RNA结合特性;结合多核糖体图谱和点击化学(HPG)检测翻译效率;建立原位OS/胶质瘤小鼠模型验证AEP抑制剂RR-11a的增敏效果;临床样本分析来自TCGA数据库和患者组织芯片。
研究结果
化疗药物触发AEP特异性切割G3BP1
顺铂等化疗药物诱导SG组装时,意外发现高浓度下SG数量反常减少。Western blot显示药物剂量依赖的G3BP1切割现象,经质谱和酶切实验鉴定出AEP在N258/N309位点的切割作用。
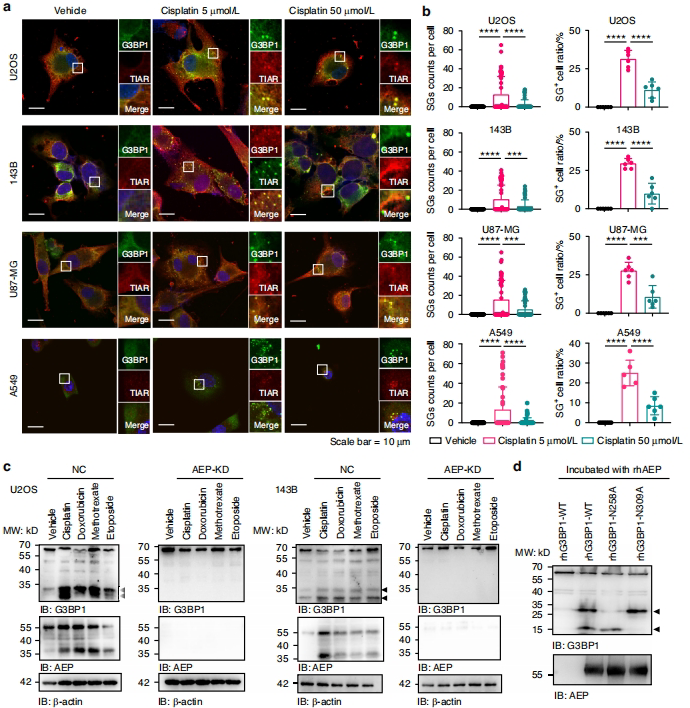
tG3BP1-Ns调控SG动态平衡
AEP敲除显著增强SG形成,而tG3BP1-Ns(1-258/1-309)通过NTF2L结构域竞争性结合全长G3BP1抑制SG组装,这种"负反馈"机制可能为肿瘤细胞提供生存优势。
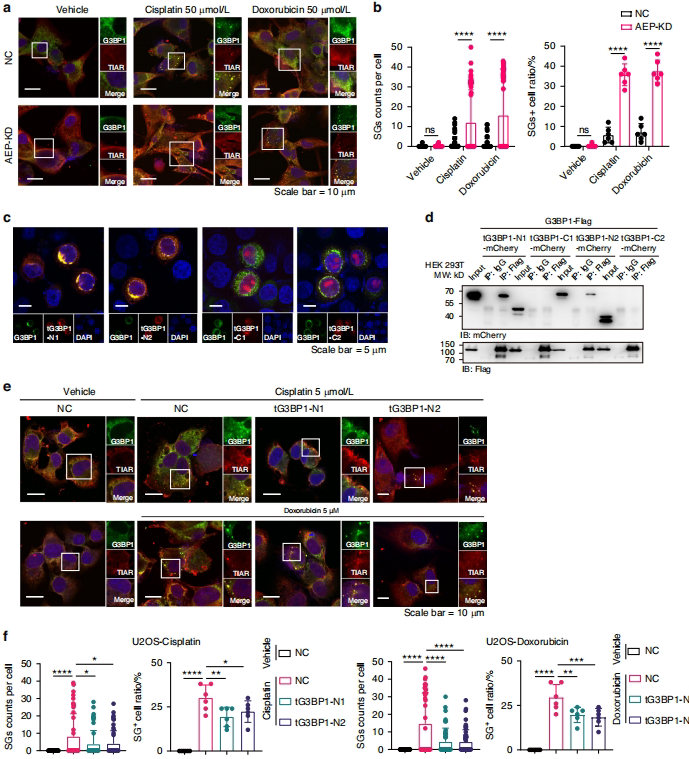
tG3BP1-Cs的核仁-线粒体双重调控
tG3BP1-Cs(259-466/310-466)携带保守RNA识别基序CCU[GCU][CG]CU[CG],在核仁内扣押核糖体蛋白(如RPS4X)mRNA抑制翻译;在线粒体则结合氧化磷酸化基因(如MT-ND1)mRNA,降低氧耗率(OCR)和活性氧(ROS)产生,形成"代谢刹车"效应。


动物模型与临床关联
原位小鼠模型显示AEP敲除使肿瘤对顺铂敏感度提升3倍,而tG3BP1片段回补逆转该效应。临床样本中AEP高表达与G3BP1切割片段水平正相关,且预示OS和胶质瘤患者不良预后。
研究结论与意义
该研究开创性揭示AEP切割G3BP1产生的蛋白片段通过"分头行动"策略:tG3BP1-Ns抑制过度SG组装避免应激损伤,tG3BP1-Cs则同步阻滞核仁翻译和线粒体代谢,形成跨细胞器的协同防御网络。这种机制在OS和胶质瘤中高度保守,解释为何传统化疗易诱发适应性耐药。
从转化医学角度看,研究证实AEP抑制剂RR-11a与化疗联用可显著延长小鼠生存期,为临床提供新组合策略。更深远的意义在于,G3BP1切割产生的"功能片段"范式可能普遍存在于肿瘤应激响应中,为理解细胞器互作网络开辟新视角。值得注意的是,AEP在切割位点选择上展现对无序区域(IDR)的偏好性,这种精确的"分子手术刀"特性使其成为极具潜力的靶向干预靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘