
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Venetoclax联合ponatinib治疗asciminib耐药慢性髓性白血病:靶向BCR::ABL1突变与凋亡通路协同作用的新策略
【字体: 大 中 小 】 时间:2025年08月27日 来源:Leukemia 13.4
编辑推荐:
针对asciminib耐药慢性髓性白血病(CML)的治疗困境,Nikola Curik团队通过建立耐药克隆模型,揭示了BCR::ABL1激酶区突变(如A337V、K294E)与白血病相关基因(ZRSR2、TP53)的共同作用机制。研究发现ponatinib单药或联合venetoclax可显著抑制肿瘤生长(p<0.001),并通过调控BCL2/BCL-XL/MCL1凋亡通路克服耐药性,为临床联合用药提供新依据。
慢性髓性白血病(CML)的治疗曾因BCR::ABL1融合基因的发现迎来革命,但耐药问题始终如影随形。近年来,靶向BCR::ABL1肉豆蔻酰口袋(myristoyl pocket)的新型变构抑制剂asciminib(ASCI)为耐药患者带来曙光,然而临床数据显示,约25%患者仍会出现获得性突变导致治疗失败。这些突变如何产生?是否存在跨通路协同耐药机制?更关键的是,能否通过联合用药策略破解这一困局?这正是发表在《Leukemia》的这项研究试图解答的核心问题。
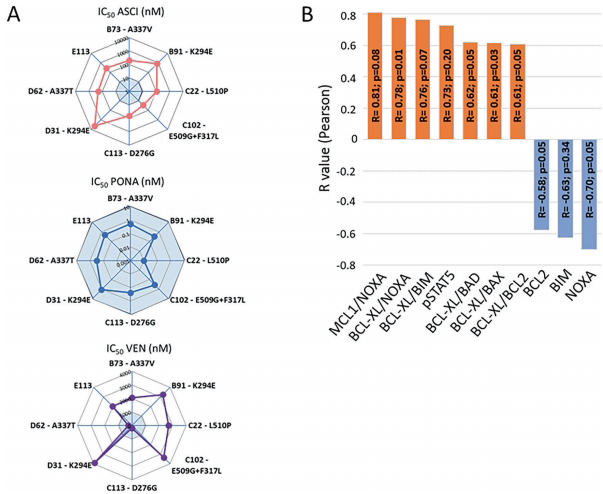
研究团队首先建立了8个asciminib耐药(ASCI-R)的KCL-22细胞克隆,通过二代测序(NGS)发现7/8克隆存在BCR::ABL1激酶区(KD)突变,包括肉豆蔻酰口袋突变(A337T/V)、SH3接触位点突变(K294E)等。值得注意的是,5/8克隆同时携带ASXL1、ZRSR2等表观遗传调控基因突变,提示表观遗传修饰可能参与耐药调控。
为评估治疗策略,研究者采用48小时药物暴露实验测定IC50值,发现所有克隆对ponatinib(PONA)敏感(IC50<10 nM),而venetoclax(VEN)敏感性呈现双峰分布——携带ZRSR2突变的C113和D62克隆显著敏感(IC50分别为190 nM和260 nM)。质谱流式(CyTOF)分析揭示敏感克隆高表达BCL2,而耐药克隆则表现为BCL-XL/MCL1与促凋亡蛋白NOXA的比值升高,且pSTAT5水平与VEN耐药呈正相关。
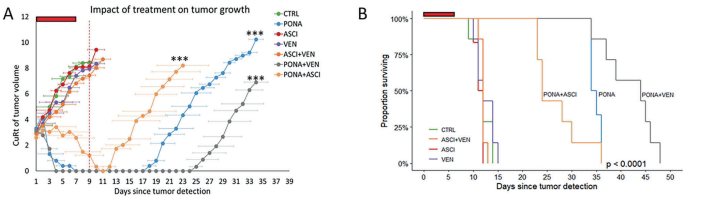
在动物模型中,PONA+VEN组合展现出卓越疗效:治疗9天时肿瘤体积较对照组减少98%(p<0.001),中位生存期从12天延长至44天。值得注意的是,复发肿瘤的克隆演化分析显示,初始占优的L510P突变克隆被清除,但残留的A337T(PONA组)和K294E突变克隆(PONA+VEN组)最终导致复发,提示需针对特定突变设计序贯治疗方案。
这项研究首次系统阐释了asciminib耐药的双重机制:BCR::ABL1激酶区突变直接干扰药物结合,而表观遗传突变通过重塑凋亡通路(如ZRSR2突变削弱MCL1稳定性)产生间接耐药。更关键的是,通过同时靶向BCR::ABL1(PONA)和凋亡检查点(VEN),可有效阻断肿瘤细胞的"逃生路线"。该策略已获临床前证据支持,如Short NJ等报道PONA+VEN方案使晚期CML患者完全缓解率达71%。未来研究需探索如何优化给药顺序以清除残留突变克隆,以及如何将这一组合应用于T315I复合突变等更棘手的临床场景。
 生物通微信公众号
生物通微信公众号
知名企业招聘