
-

生物通官微
陪你抓住生命科技
跳动的脉搏
RNA剪接因子SF3B1突变导致UBA1异常剪接:骨髓增生异常肿瘤治疗新靶点的发现
【字体: 大 中 小 】 时间:2025年08月27日 来源:Leukemia 13.4
编辑推荐:
本研究针对SF3B1突变型骨髓增生异常肿瘤(MDS-SF3B1)中RNA错误剪接的难题,通过建立患者来源的iPSC模型和全转录组测序,首次发现泛素激活酶UBA1的特异性异常剪接(UBA1ms)。该事件导致UBA1蛋白稳定性降低,使突变细胞对UBA1抑制剂TAK-243敏感性显著增强。研究在MDS患者队列中验证了UBA1ms的独特性,为SF3B1突变型MDS的精准治疗提供了新策略。论文发表于《Leukemia》。
研究背景与意义
骨髓增生异常肿瘤(Myelodysplastic neoplasms, MDS)是一组起源于造血干细胞的克隆性疾病,其特征性SF3B1基因突变会导致RNA剪接紊乱,引发无效造血和难治性贫血。尽管已知SF3B1突变(如K700E)通过激活隐蔽剪接位点影响ABCB7、ALAS2等基因,但现有治疗手段仍面临两大挑战:一是剪接异常的动态复杂性难以建模,二是缺乏特异性靶点。
技术方法概要
研究团队利用SF3B1K700E突变型和野生型(WT)诱导多能干细胞(iPSC)分化为造血细胞,通过全长RNA测序发现UBA1异常剪接事件。采用患者队列(83例SF3B1突变型MDS)验证临床相关性,结合K562细胞模型和HEK293T转染实验解析蛋白稳定性机制。关键实验包括:多核糖体分析、环己酰亚胺追踪实验、蛋白质免疫印迹,以及原代CD34+细胞集落形成试验评估TAK-243药效。
研究结果
1. iPSC模型揭示UBA1ms事件
通过对比SF3B1K700E与WT iPSC分化的造血细胞,RNA测序发现UBA1内含子5保留导致的135bp异常插入。该事件在突变型细胞中特异性存在,产生含45个额外氨基酸的蛋白变体。
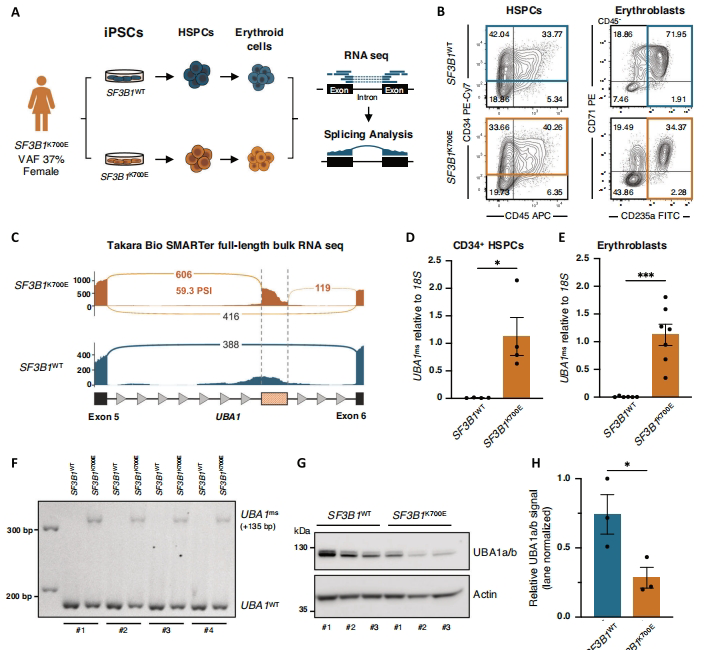
2. UBA1ms导致蛋白不稳定性
AlphaFold2预测显示插入序列破坏UBA1腺苷化结构域折叠。实验证实UBA1ms蛋白半衰期仅2.5小时(WT>100小时),经蛋白酶体降解后,突变细胞总UBA1蛋白水平降低40%。
3. SF3B1突变细胞对UBA1抑制敏感
TAK-243处理SF3B1K700E K562细胞的IC50为32nM(WT细胞为82nM)。在原代MDS患者CD34+细胞中,TAK-243选择性减少突变克隆(CFU下降60%),而正常造血祖细胞保持活性。
4. 临床队列验证特异性
83例SF3B1突变型MDS患者均检测到UBA1ms(PSI=15-25%),而SRSF2或U2AF1突变患者及健康供体完全缺失该事件。
结论与展望
本研究首次阐明SF3B1突变通过UBA1异常剪接产生"合成致死"效应——突变细胞因基础UBA1活性降低而更依赖残余UBA1功能,使TAK-243成为潜在治疗选择。该发现为理解剪接因子突变肿瘤的靶向治疗提供了范式:即异常剪接不仅导致功能缺失,还可能创造新的治疗窗口。未来需探索TAK-243与PARP抑制剂的联合方案,以克服突变克隆的残留存活。
(注:全文数据来自原文图1-5及补充材料,作者单位包括瑞典卡罗林斯卡医学院等机构,通讯作者为Vanessa Lundin)
 生物通微信公众号
生物通微信公众号
知名企业招聘