
-

生物通官微
陪你抓住生命科技
跳动的脉搏
干扰素刺激基因CCND3作为宿主限制因子抑制高致病性班达病毒的机制研究
【字体: 大 中 小 】 时间:2025年08月27日 来源:Nature Communications 15.7
编辑推荐:
本研究揭示了干扰素刺激基因CCND3作为新型宿主限制因子对抗高致病性班达病毒(SFTSV)的分子机制。研究人员通过ISG cDNA文库筛选发现CCND3能特异性靶向病毒核蛋白(NP),通过其CN结构域阻断NP多聚化、NP-RNA结合和NP-L相互作用,从而抑制病毒核糖核蛋白(RNP)复合体的组装与功能。该发现为理解病毒-宿主互作提供了新视角,并为开发抗病毒策略提供了潜在靶点。
在病毒与宿主的永恒博弈中,班达病毒(Bandavirus)近年来成为全球公共卫生的新威胁。其中,严重发热伴血小板减少综合征病毒(SFTSV)作为代表性高致病性成员,已在中国、日本、韩国等地造成多次疫情暴发,病死率高达30%。这类病毒通过蜱虫叮咬传播,能引起发热、血小板减少和多器官衰竭等严重症状。尽管干扰素(IFN)系统是宿主抵御病毒感染的第一道防线,但具体哪些干扰素刺激基因(ISGs)能有效对抗班达病毒,以及它们的作用机制仍不清楚。这一知识缺口严重制约了抗病毒策略的开发。
为破解这一科学难题,由Zhao Xu、Zhenyu Jiang等组成的研究团队在《Nature Communications》发表了突破性研究成果。研究人员首先建立了一个创新性的筛选平台:将378个ISG cDNA表达文库与SFTSV微型复制子报告系统相结合,通过高通量成像分析EGFP阳性细胞比例,成功鉴定出234个潜在抗病毒ISG和18个可能促病毒的ISG。其中,细胞周期蛋白D3(CCND3)作为排名靠前的候选分子引起了研究人员的特别关注——这个传统认为主要调控细胞周期的蛋白,竟展现出显著的抗病毒潜力。
关键技术方法包括:1) ISG cDNA文库与病毒微型复制子报告系统的高通量筛选;2) CRISPR-Cas9基因编辑构建CCND3、CDK4/6等基因敲除细胞系;3) 核质分离和免疫共沉淀(Co-IP)分析蛋白互作;4) AlphaFold2结构预测与功能域突变验证;5) 使用A129(IFNAR1-/-)和C57BL/6J小鼠模型进行体内功能验证;6) 化学交联(DSS)和RNA-pulldown等技术分析蛋白多聚化与RNA结合特性。
研究发现SFTSV感染能显著上调CCND3的转录水平,这种现象在HEK293、THP-1等多种细胞系以及原代PBMC和BMDM中均得到验证。更有趣的是,免疫荧光和核质分离实验显示,静息状态下主要定位于细胞核的CCND3,在病毒感染后会发生明显的胞质转位。这种表达上调和定位改变暗示CCND3可能直接参与了对病毒复制的调控。
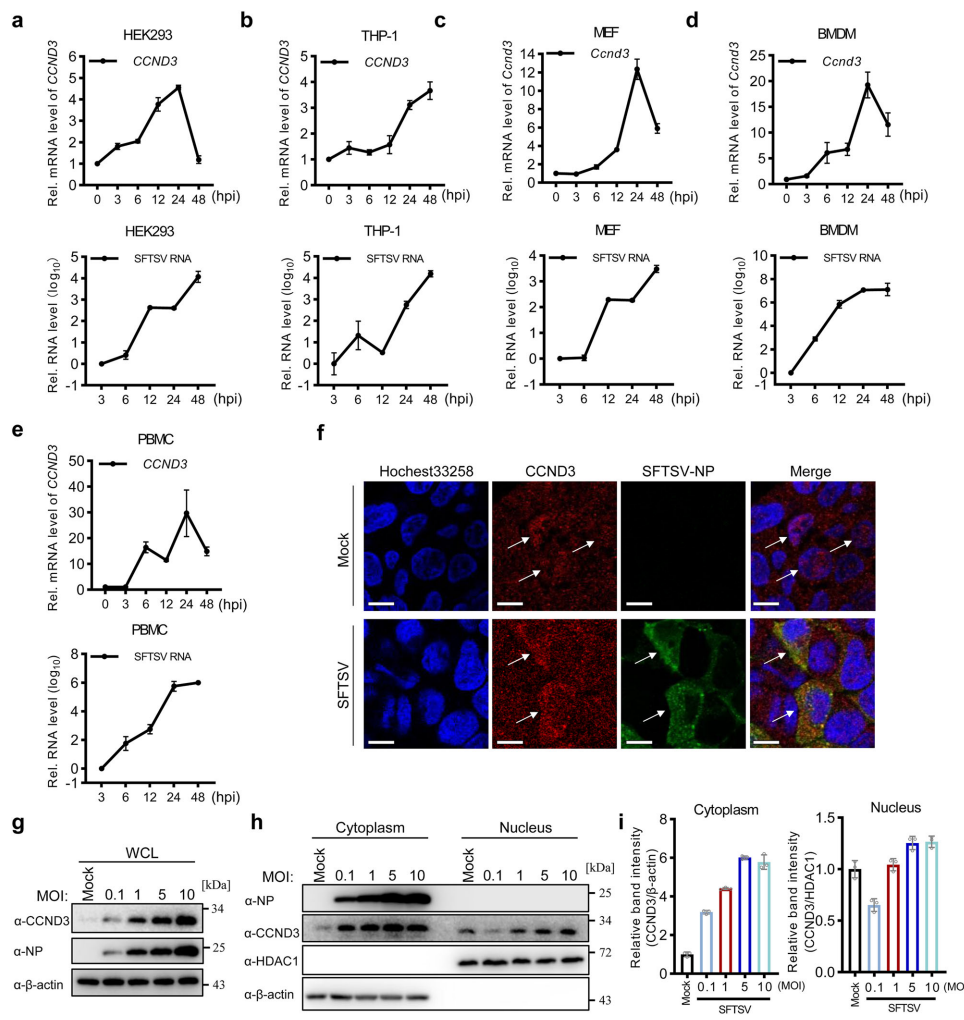
通过系列功能获得/缺失实验,研究团队确证了CCND3的抗病毒作用。过表达CCND3可显著抑制SFTSV RNA复制、蛋白表达和子代病毒产生;反之,通过RNAi敲低或CRISPR-Cas9敲除CCND3则会增强病毒复制。这种抑制作用同样见于其他班达病毒(GTV和HRTV)。在动物模型中,CCND3缺陷小鼠表现出更高的病毒载量、更严重的血小板减少和器官损伤,证实了CCND3在体内的保护作用。
深入机制研究发现,CCND3能特异性结合SFTSV NP蛋白,且这种相互作用不依赖RNA。通过AlphaFold2结构预测和系列截短体实验,研究人员锁定CCND3的CN结构域(残基62-254)和NP的"头部"区域(N-lobe和C-lobe)是关键互作界面。特别值得注意的是,CCND3结合会物理性阻碍NP多聚化、封闭NP的RNA结合腔(CavityR),并破坏NP与病毒聚合酶(L)的相互作用,从而全面抑制RNP复合体的组装与功能。

研究还揭示了病毒对抗CCND3的"军备竞赛"策略:SFTSV的非结构蛋白NSs能抑制IFN诱导的CCND3表达,并通过激活自噬途径促进CCND3降解。这种双向调控为理解病毒-宿主共进化提供了生动案例。
该研究首次系统阐明了CCND3作为ISG的抗病毒机制,突破了传统认为其仅参与细胞周期调控的认知。发现CCND3能直接靶向病毒复制核心 machinery——RNP复合体,这为开发广谱抗病毒药物提供了新思路。特别是鉴定出的CCND3 CN结构域(含关键氨基酸M64、C68等),可作为设计抗病毒多肽的理想靶标。研究还揭示了班达病毒与宿主免疫系统复杂的互作网络,为理解病毒致病机制和免疫逃逸策略提供了重要参考。这些发现不仅丰富了宿主防御机制的理论基础,也为应对SFTSV等新发传染病威胁提供了潜在干预策略。

 生物通微信公众号
生物通微信公众号
知名企业招聘