
-

生物通官微
陪你抓住生命科技
跳动的脉搏
GAF与H3K27ac双标记机制调控神经干细胞命运记忆的差异性传递
【字体: 大 中 小 】 时间:2025年08月27日 来源:Nature Communications 15.7
编辑推荐:
本研究揭示了神经干细胞(NSCs)通过GAF(GAGA因子)和H3K27ac的双重有丝分裂书签(mitotic bookmarking)机制,在不对称分裂中差异性传递细胞命运记忆的创新机制。研究人员发现GAF通过相分离形成凝聚体,在分裂期保留于染色体上,招募HDAC1清除分化基因位点的H3K27ac标记以维持NSCs自我更新;而在神经前体细胞中,SWI/SNF复合物竞争性取代GAF,保留H3K27ac以激活分化基因。该研究为理解发育过程中细胞命运锁定提供了新范式,发表于《Nature Communications》。
神经发育中的“记忆密码”如何传递?
大脑发育过程中,神经干细胞(NSCs)通过不对称分裂产生自我更新的干细胞和分化的子代细胞,这一过程的精确调控是形成复杂神经网络的基石。然而,一个长期未解的谜题是:在有丝分裂期间,当染色质高度凝缩、转录几乎停滞时,NSCs如何将自我更新的“记忆”传递给子代细胞?同时,其姐妹细胞又如何“擦除”这种记忆并开启分化程序?
传统观点认为,有丝分裂书签(mitotic bookmarking)通过标记关键基因位点,帮助细胞在分裂后快速重建转录程序。但这一机制在不对称分裂中的调控策略尚不明确。Rulan Zhang等团队在《Nature Communications》发表的研究,首次揭示了GAF(GAGA因子)与H3K27ac的双重书签机制,通过“分子竞争”实现细胞命运记忆的差异性传递,为发育生物学和表观遗传调控提供了全新视角。
关键技术方法
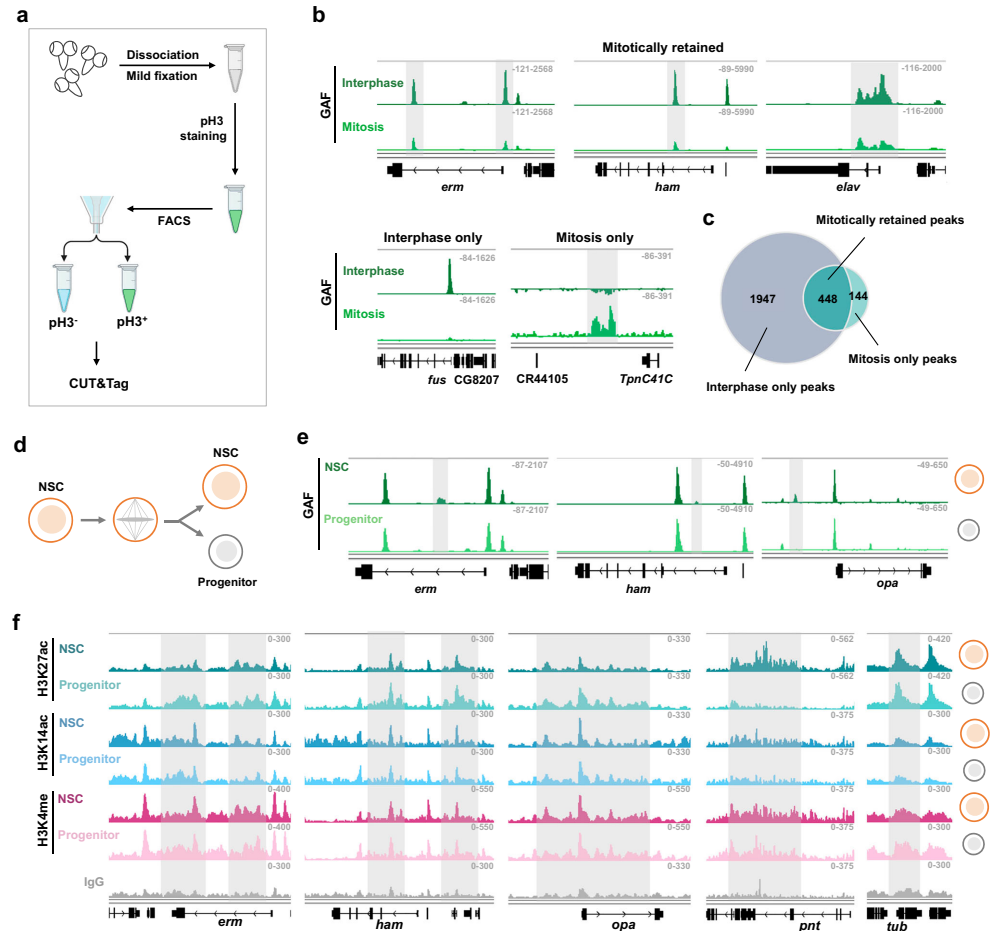
研究结合了果蝇幼虫中枢脑区II型NSCs模型,通过CRISPR-Cas9基因编辑构建GAF敲除和荧光标记品系,利用活细胞成像(FRAP)和光激活相分离(optoDroplet)分析GAF凝聚体动态;采用CUT&Tag技术绘制有丝分裂期与间期NSCs中GAF、H3K27ac和HDAC1的基因组定位;通过RNA-seq和ATAC-seq解析转录组和染色质开放性变化;并利用MARCM(基于可抑制细胞标记的嵌合分析)和荧光报告系统验证功能机制。
研究结果
1. GAF在分裂期NSCs中通过相分离保留
研究发现GAF通过BTB结构域驱动相分离,形成动态凝聚体。FRAP实验显示,间期GAF凝聚体具有液态流动性(恢复率>80%),而在分裂期则呈现固态特征(恢复率<50%),这种相变特性使其能锚定在凝缩染色体上。
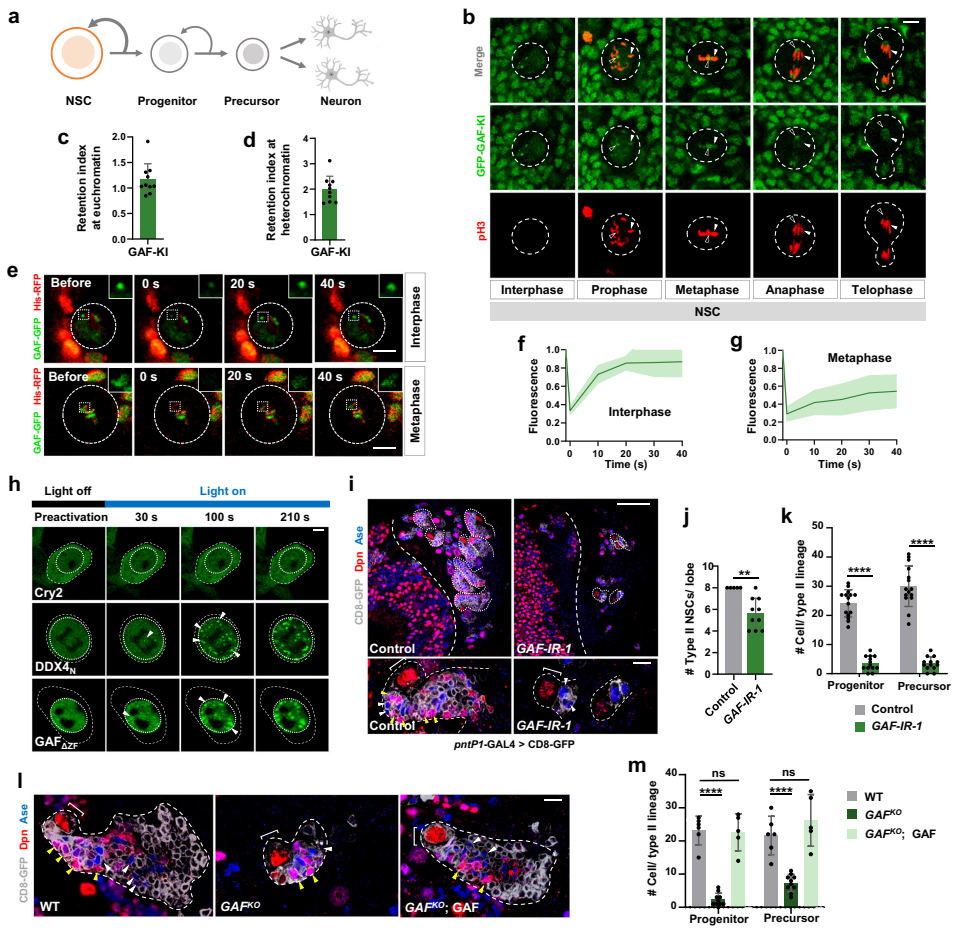
2. GAF抑制分化基因以维持干细胞特性
CUT&Tag分析发现GAF特异性结合erm、ham等分化基因的增强子。敲除GAF导致这些基因在NSCs中异常激活,引发干细胞耗竭;而过表达GAF则抑制分化基因,诱发神经前体细胞肿瘤性增殖。
3. 双书签机制实现命运记忆分化
关键发现是分化基因位点同时被GAF和H3K27ac标记。在NSCs子代细胞中,GAF招募HDAC1清除H3K27ac以抑制分化基因;而在神经前体细胞中,SWI/SNF复合物(含ARID1B/Osa亚基)竞争性取代GAF,保留H3K27ac并激活分化程序。
4. 相分离强度的精确调控至关重要
改造GAF的BTB结构域实验表明,相分离能力过弱(如GAF△BTB)导致书签功能丧失,而过强(如Pros.N7-GAF融合体)则引发神经前体细胞去分化,说明GAF凝聚体的物理性质需要精确调控。
结论与意义
该研究揭示了发育过程中细胞命运记忆传递的表观遗传新机制:
双重书签:GAF和H3K27ac的协同标记使NSCs处于“待命状态”,为不对称分裂后的命运决定提供表观缓冲;
分子竞争:SWI/SNF复合物在神经前体细胞中的选择性激活,实现了对相同书签的差异性解读;
相分离调控:GAF凝聚体的物理性质直接影响其书签功能,为理解相分离在发育调控中的作用提供范例。
这项研究不仅解决了神经发育领域的核心问题,其揭示的“书签-竞争”机制可能广泛存在于其他干细胞系统。例如,哺乳动物中GAF同源蛋白Th-POK也参与T细胞命运决定,提示该机制的进化保守性。未来研究可进一步探索:(1)有丝分裂期间H3K27ac“写入”的调控机制;(2)SWI/SNF复合物在子代细胞中特异性激活的分子开关。这些发现为神经退行性疾病和脑肿瘤的治疗策略提供了新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘