
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向FimH的甘露寡糖微凝胶:炎症性肠病治疗的新型生物启发策略
【字体: 大 中 小 】 时间:2025年08月27日 来源:Nature Communications 15.7
编辑推荐:
本研究针对炎症性肠病(IBD)治疗中抗生素耐药性和微生物群失衡的难题,开发了一种基于FimH捕获的甘露寡糖(MOS)微凝胶系统。通过全水相微流控技术构建的孔隙化微凝胶可特异性吸附致病性大肠杆菌(AIEC),有效缓解DSS诱导的小鼠结肠炎症状,同时重塑肠道菌群平衡。这项发表在《Nature Communications》的研究为IBD治疗提供了非抗生素的精准干预策略。
炎症性肠病(IBD)作为全球发病率持续攀升的慢性免疫性疾病,其治疗面临巨大挑战。现有疗法如免疫抑制剂和生物制剂虽能缓解症状,却常伴随感染风险增加、骨质疏松等副作用,更可能破坏肠道微生态平衡。特别值得注意的是,黏附侵袭性大肠杆菌(AIEC)通过FimH黏附素与肠道细胞表面CEACAM6糖蛋白的甘露糖残基结合,在克罗恩病发病机制中扮演关键角色。传统针对FimH的小分子抑制剂虽有一定效果,但存在被肠道菌群代谢、靶向性不足等问题。《Nature Communications》最新发表的这项研究创新性地提出"诱饵"策略,通过生物材料工程手段开发出能特异性捕获AIEC的功能化微凝胶。
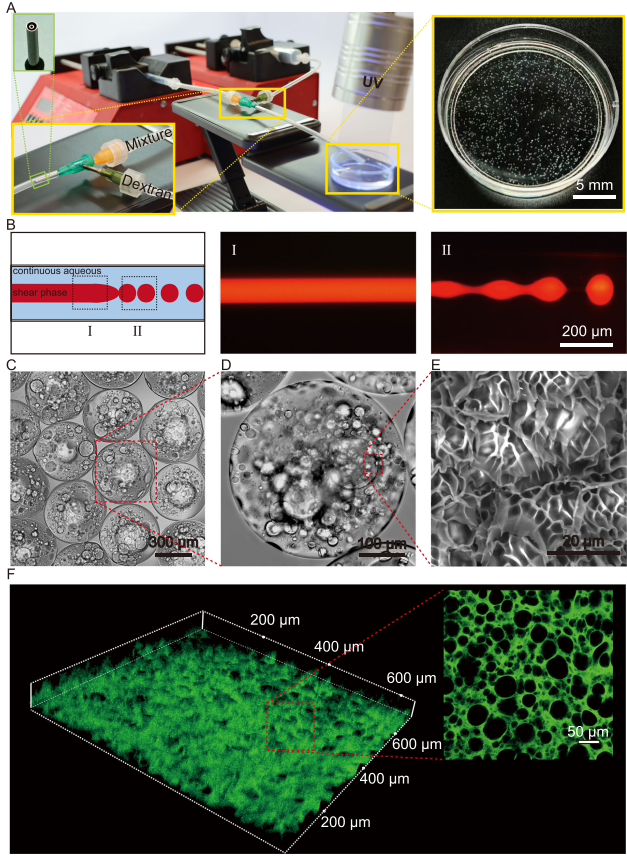
研究团队主要运用三项关键技术:1)基于全水相微流控的孔隙化微凝胶制备技术,以葡聚糖/Dextran为连续相,甲基丙烯酰化明胶(GelMA)和聚环氧乙烷(PEO)构成分散相;2)表面等离子共振(SPR)技术分析FimH与不同糖分子的结合特性;3)DSS诱导的小鼠结肠炎模型评估治疗效果,结合16S rRNA测序分析肠道菌群变化。
【Fabrication and characterization of MOS MGs】
研究人员通过创新的全水相微流控技术,成功制备出负载甘露寡糖(MOS)的多孔GelMA微凝胶。这种微凝胶具有可调控的孔隙结构,当GelMA与PEO体积比从10:1调整为2:1时,孔隙率显著增加。与实心微凝胶相比,多孔结构使细菌吸附能力提升3倍以上,体内滞留时间延长50%。
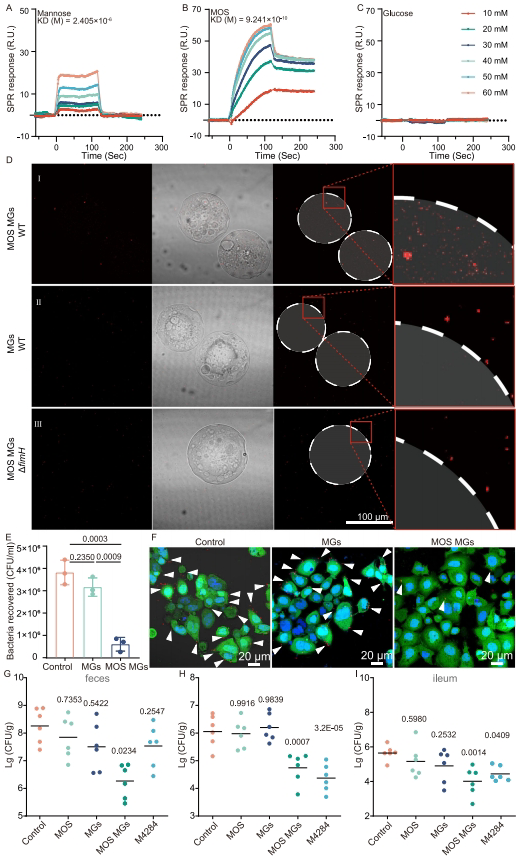
【MOS MGs block AIEC adhesion to intestinal epithelial cells by binding with FimH】
表面等离子共振实验证实MOS与FimH的结合力(KD=2.3μM)强于单一甘露糖分子。体外实验显示MOS微凝胶能特异性吸附野生型AIEC(LF82),而对ΔfimH突变株无吸附作用。在Caco-2细胞共培养模型中,MOS微凝胶使AIEC黏附减少85%,效果优于阳性对照药物M4284。
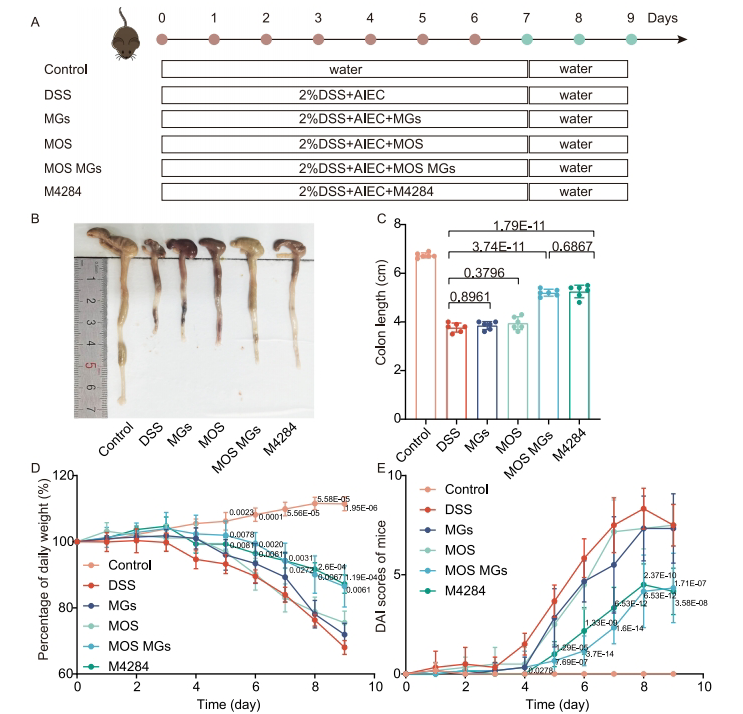
【Therapeutic efficacy of MOS MGs in the mice model with DSS-induced colitis】
在DSS诱导的结肠炎模型中,MOS微凝胶治疗组表现出显著疗效:结肠长度增加35%,疾病活动指数(DAI)降低60%,肠屏障功能相关蛋白ZO-1表达上调2.1倍。组织学评分显示,黏膜炎症细胞浸润减少70%,效果与阳性药物相当。
【MOS MGs modulate of gut microbiome】
16S rRNA测序分析揭示MOS微凝胶可重塑肠道菌群:双歧杆菌科(Bifidobacteriaceae)相对丰度增加3.5倍,肠杆菌科(Enterobacteriaceae)减少65%。LEfSe分析显示Prevotellaceae等有益菌显著富集,表明该治疗不仅能清除病原菌,还可促进微生态平衡。

这项研究开创性地将生物材料工程与微生物干预策略相结合,突破传统IBD治疗的局限性。其重要意义体现在三个方面:首先,通过"竞争性吸附"而非杀灭的方式干预致病菌,避免抗生素耐药性产生;其次,微凝胶载体可精准递送MOS至病变部位,解决小分子药物易被代谢的难题;最重要的是,该策略在清除AIEC的同时促进益生菌增殖,实现"祛邪扶正"的双重调节。由于FimH在多种致病菌中高度保守,该平台技术有望拓展至尿路感染等其他细菌性疾病的治疗。未来研究可进一步优化微凝胶结构,探索与现有疗法的协同效应,推动IBD治疗进入精准调控微生物群的新时代。
 生物通微信公众号
生物通微信公众号
知名企业招聘