
-

生物通官微
陪你抓住生命科技
跳动的脉搏
免疫检查点抑制剂联合化疗治疗广泛期小细胞肺癌的真实世界疗效与年龄差异分析:Tokushukai真实世界数据项目(TREAD)06研究
【字体: 大 中 小 】 时间:2025年08月28日 来源:BMC Cancer 3.4
编辑推荐:
本研究针对广泛期小细胞肺癌(ED-SCLC)治疗困境,通过Tokushukai医疗集团多中心真实世界数据,评估了免疫检查点抑制剂(ICI)联合铂类化疗的生存获益。结果显示ICI组合疗法使中位总生存期(OS)显著延长至13.0个月(HR 0.589),但75岁以上患者获益有限(8.9 vs 8.6个月)。该研究为临床实践提供了重要循证依据,尤其揭示了老年患者的治疗响应差异。
小细胞肺癌(SCLC)作为最具侵袭性的肺癌亚型,约占肺癌病例的10-15%,其特点是进展迅速、早期转移。广泛期(ED)-SCLC患者占比高达70-80%,尽管对化疗初始敏感,但中位生存期仅8-13个月,数十年来治疗进展有限。这种"高响应-快复发"的治疗困境,促使研究者探索新的治疗策略。免疫检查点抑制剂(ICI)的出现为ED-SCLC治疗带来了转机,2019年atezolizumab在日本获批成为首个用于ED-SCLC的ICI药物。然而,临床试验的严格入组标准与真实世界患者的异质性之间存在显著差距,特别是对老年患者和体能状态较差人群的疗效数据缺乏。
为填补这一知识空白,Tomoya Fukui等研究者开展了这项覆盖日本城乡46家医院的大规模回顾性研究。研究纳入2010-2022年间590例接受一线铂类化疗的ED-SCLC患者,通过电子病历系统和化疗管理平台采集数据,采用逆概率加权(IPTW)等方法控制混杂因素,重点比较ICI联合治疗与传统化疗的生存差异。
关键技术方法包括:1) 基于Tokushukai医疗集团标准化电子病历系统(e-Karte)和化疗管理系统(srvApmDrop)的多中心数据采集;2) 采用Kaplan-Meier法和Cox比例风险模型分析生存数据;3) 应用IPTW方法平衡治疗组间基线差异;4) 通过中性粒细胞淋巴细胞比值(NLR)和改良格拉斯哥预后评分(mGPS)等评估全身炎症状态。
研究结果呈现多个重要发现:
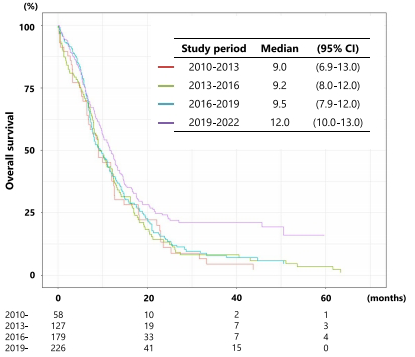
总体生存趋势:全队列中位OS为10.0个月,但随时间显著改善,ICI获批后的2019-2022年组达到12.0个月,显示治疗进步带来的生存获益。
ICI联合治疗优势:接受ICI联合治疗的患者中位OS显著优于单纯化疗组(13.0 vs 9.7个月,p=0.011),经IPTW调整后HR为0.666(95%CI 0.483-0.919),证实真实世界中ICI的生存获益与临床试验一致。
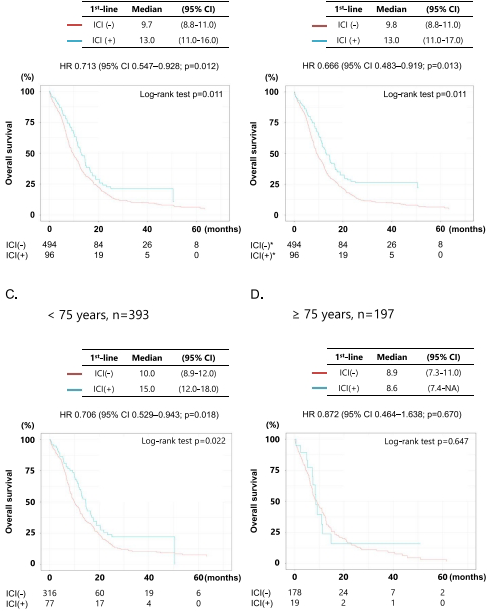
年龄分层差异:<75岁患者从ICI治疗中获益显著(中位OS 15.0 vs 10.0个月,p=0.022),而≥75岁患者未见统计学差异(8.9 vs 8.6个月,p=0.647),提示老年患者可能需要个体化治疗策略。
预后因素分析:多变量Cox模型确认ICI联合治疗是OS的独立保护因素(HR 0.589),其他有利因素包括女性、PS 0-1、III期疾病和NLR<5。值得注意的是,≥75岁年龄本身并非独立预后因素(HR 1.185,p=0.116)。
讨论部分深入剖析了几个关键问题:首先,研究验证了IMpower133和CASPIAN等关键临床试验结果在真实世界的可重复性,但值得注意的是,本研究纳入更多老年(33%≥75岁)和PS较差患者(21% PS 2-4),增强了结果的临床适用性。其次,年龄相关疗效差异可能源于免疫衰老、合并症或治疗耐受性等因素,但样本量限制(≥75岁ICI组仅19例)需要谨慎解读。最后,研究识别NLR≥5作为不良预后指标,为临床决策提供了简易生物标志物。
该研究发表在《BMC Cancer》的重要价值在于:首次系统评估了ICI在ED-SCLC真实世界中的年龄特异性疗效,为临床实践提供了三点关键启示:1) 应推荐所有适合患者接受ICI联合治疗,包括部分老年患者;2) 对≥75岁患者需综合评估预期获益与风险;3) 亟需开发预测性生物标志物优化患者选择。这些发现将直接影响治疗指南制定和临床决策,同时为后续研究指明了方向,特别是针对老年人群的免疫治疗优化策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘