
-

生物通官微
陪你抓住生命科技
跳动的脉搏
ESRP1启动子报告基因作为DNA甲基转移酶抑制剂的体内传感器:肾细胞癌表观遗传治疗新工具
【字体: 大 中 小 】 时间:2025年08月28日 来源:BMC Biotechnology 3.4
编辑推荐:
本研究针对DNA甲基转移酶(DNMT)抑制剂高通量筛选技术缺失的难题,创新性地构建了基于ESRP1启动子的生物发光报告系统(ESRP1-P-Luc2)。研究人员发现肾细胞癌(RCC)中ESRP1因启动子高甲基化而表达沉默,恢复其表达可通过下调cyclin A2诱导G1期阻滞抑制肿瘤。该系统成功实现了5-Aza-CdR在细胞和活体水平的药效动态监测,为抗RCC表观遗传药物开发提供了新型HTS平台。
在肿瘤表观遗传学领域,DNA甲基转移酶(DNMT)介导的启动子高甲基化是肿瘤抑制基因沉默的关键机制。尽管DNMT抑制剂如5-氮杂-2'-脱氧胞苷(5-Aza-CdR)能逆转这一过程,但缺乏高效监测工具严重阻碍了新药研发。肾细胞癌(RCC)作为常见泌尿系恶性肿瘤,其表观遗传调控机制尚未完全阐明。Lecheng Lin2?、Lingli Chen2?等研究者聚焦上皮剪接调节蛋白1(ESRP1),发现其在RCC中呈现启动子高甲基化特征,这为开发新型监测系统提供了分子基础。
研究团队首先通过UALCAN和HPA数据库分析确认ESRP1在肾透明细胞癌(KIRC)中显著低表达。BSP和MSRE-qPCR技术揭示A498细胞中ESRP1启动子CpG岛1的23个位点甲基化率达100%,而5-Aza-CdR处理可显著降低甲基化水平。功能实验显示ESRP1过表达通过下调cyclin A2使RCC细胞阻滞于G1期,软琼脂克隆形成实验证实其抑制肿瘤发生能力。
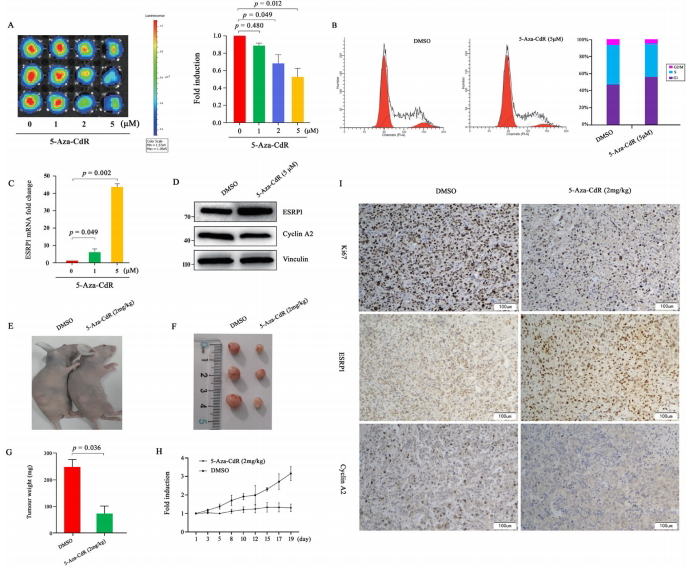
研究核心创新在于构建pGL4.19-ESRP1-P-Luc2报告系统。该载体将ESRP1启动子与荧光素酶基因融合,在稳定转染的A498-ESRP1-P-Luc2细胞中,5-Aza-CdR处理使荧光素酶活性提升140倍,且体内外实验均显示生物发光信号与ESRP1表达呈正相关。SCID-裸鼠移植瘤模型证实,该系统可实时监测2 mg/kg 5-Aza-CdR引起的肿瘤部位信号2.6倍增强。
关键技术包括:生物信息学分析ESRP1表达谱;BSP和MSRE-qPCR检测启动子甲基化;构建ESRP1-P-Luc2报告系统;建立A498-Luc2/A498-ESRP1-P-Luc2稳转细胞系;软琼脂克隆形成实验评估肿瘤发生能力;流式细胞术分析细胞周期;裸鼠异种移植瘤模型结合BLI动态监测。
ESRP1在RCC细胞中低表达且启动子区域高甲基化
数据库分析和实验验证显示ESRP1在RCC细胞系(特别是A498)中表达显著低于正常细胞,BSP证实其启动子CpG岛完全甲基化,MSRE-qPCR显示5-Aza-CdR可有效去甲基化。
恢复ESRP1表达通过G1期阻滞抑制RCC增殖
过表达ESRP1使cyclin A2蛋白水平下降,诱导G1期阻滞,软琼脂实验显示克隆形成减少58%。AAV介导的体内过表达使肿瘤体积缩小42%,证实其抑癌作用。
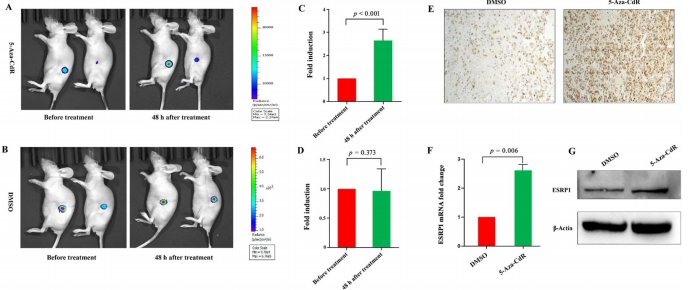
ESRP1-P-Luc2报告系统实现DNMT抑制剂动态监测
报告系统在5 μM 5-Aza-CdR处理下荧光素酶活性提升140倍,体内实验显示肿瘤区域信号增强2.6倍,Western blot证实ESRP1蛋白同步上调。
该研究首次阐明ESRP1通过cyclin A2调控RCC细胞周期的分子机制,并创新性地开发出基于表观遗传调控的报告系统。其重要意义在于:为DNMT抑制剂筛选提供首个RCC特异性HTS工具;证实ESRP1启动子甲基化状态可作为药效标志物;建立的A498-ESRP1-P-Luc2细胞系可推广至其他表观遗传药物评估。尽管存在细胞模型单一等局限,但为开发靶向DNA甲基化的抗RCC药物奠定了关键技术基础。论文发表于《BMC Biotechnology》,为表观遗传治疗领域提供了兼具理论价值和应用前景的研究范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘