
-

生物通官微
陪你抓住生命科技
跳动的脉搏
ACSS2-TFEB轴调控头颈鳞癌自噬机制:揭示肿瘤恶性进展新靶点
【字体: 大 中 小 】 时间:2025年08月28日 来源:Cell Death & Disease 9.6
编辑推荐:
本研究针对头颈鳞状细胞癌(HNSCC)高转移和复发难题,深入探究了ACSS2-TFEB信号轴通过调控自噬-溶酶体通路促进肿瘤进展的分子机制。研究人员通过临床样本分析结合体外实验证实,ACSS2通过激活转录因子EB(TFEB)维持溶酶体功能,从而促进自噬流完成,最终驱动HNSCC细胞增殖、迁移和侵袭。该研究为开发靶向ACSS2-TFEB轴的新型抗肿瘤策略提供了理论依据。
头颈鳞状细胞癌(HNSCC)作为全球第六大常见恶性肿瘤,其高转移性和易复发的特性严重威胁患者生存。尽管现有治疗手段不断进步,晚期患者五年生存率仍不足50%。自噬(Autophagy)这一细胞自我降解过程在肿瘤中扮演着"双刃剑"角色——既能抑制早期癌变,又可为进展期肿瘤提供能量支持。然而,HNSCC中自噬调控的具体分子机制尚未阐明,这成为制约靶向治疗开发的关键瓶颈。
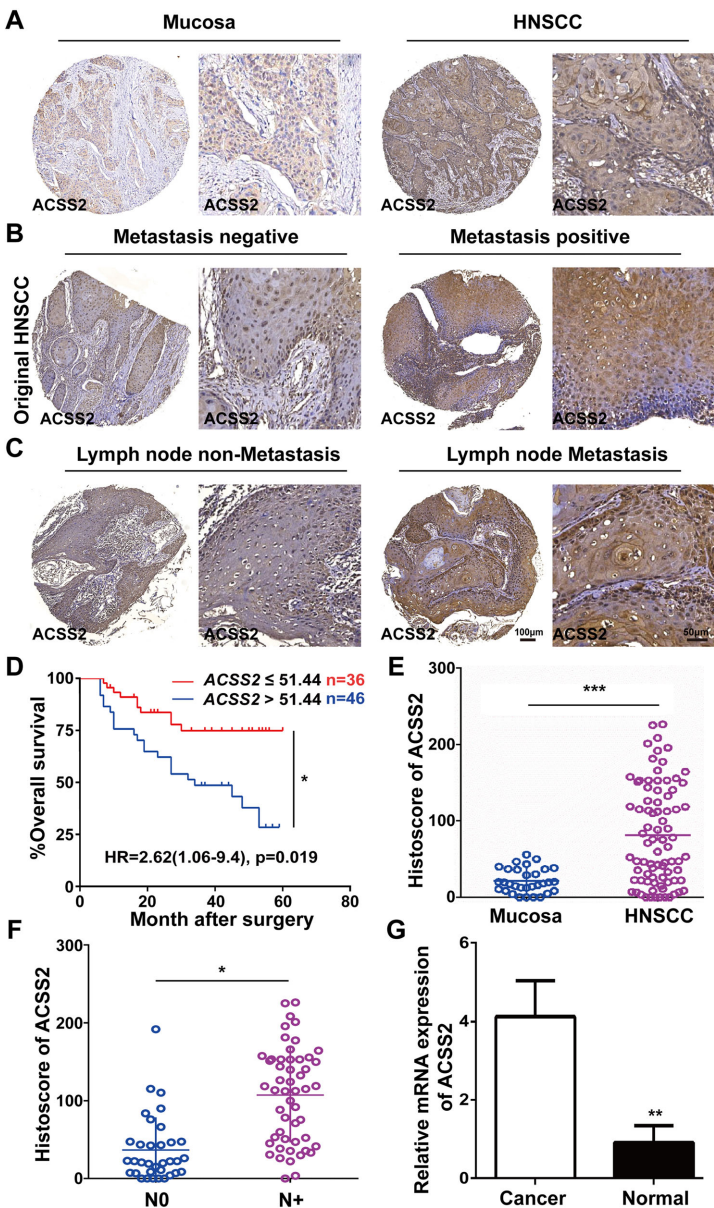
《Cell Death and Disease》最新发表的研究揭开了这一谜题。Danhui Yin等科学家发现,酰基辅酶A合成酶短链家族成员2(ACSS2)与转录因子EB(TFEB)构成的核心调控轴,通过独特机制操纵着HNSCC的自噬机器。研究人员首先在82例临床样本中发现ACSS2表达与淋巴结转移和不良预后显著相关,随后通过基因敲除实验证实ACSS2缺失会同时抑制肿瘤细胞迁移、侵袭和增殖三大恶性表型。
关键技术方法包括:82例HNSCC患者组织样本队列分析;免疫组化(IHC)和Western blot检测蛋白表达;shRNA介导的ACSS2/ATG5基因敲除;TFEB过表达质粒转染;RFP-GFP-LC3双标腺病毒自噬流检测;DQ-BSA和LysoSensor荧光探针评估溶酶体功能;以及裸鼠移植瘤模型验证。
【ACSS2上调与HNSCC不良预后相关】
临床数据分析显示,ACSS2在HNSCC组织中表达显著高于正常黏膜,且与TNM分期和淋巴结转移呈正相关。Kaplan-Meier曲线证实高表达ACSS2患者生存期更短。
【ACSS2敲除抑制肿瘤恶性行为】
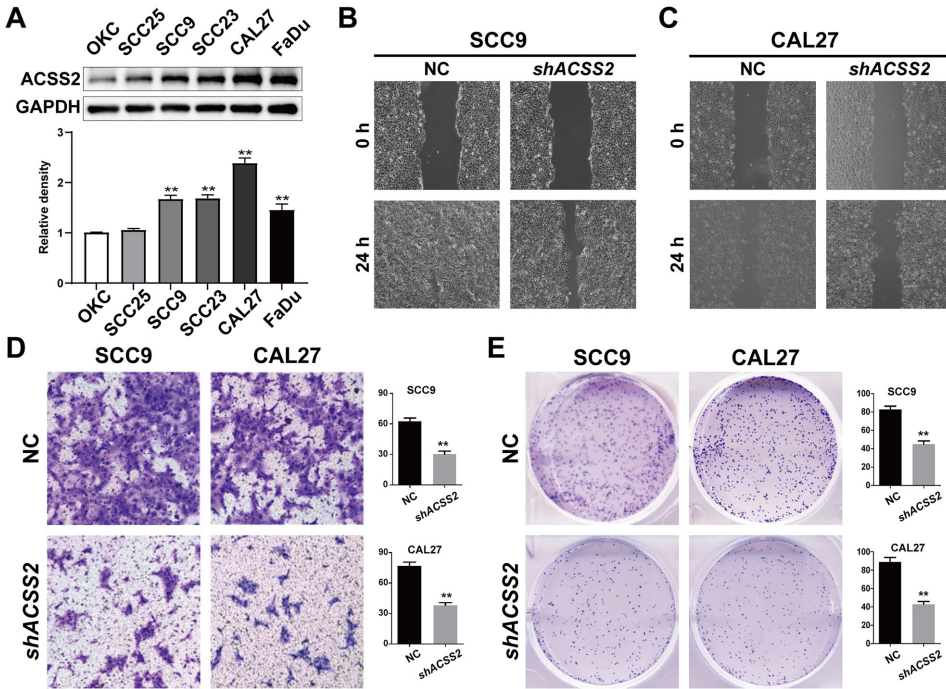
在SCC9和CAL27细胞系中,ACSS2敲除使伤口愈合率下降40-50%,Transwell侵袭细胞数减少60%,克隆形成能力降低55%。值得注意的是,在低表达ACSS2的SCC25细胞中过表达该基因可重现促癌效应。
【自噬流阻滞的机制解析】
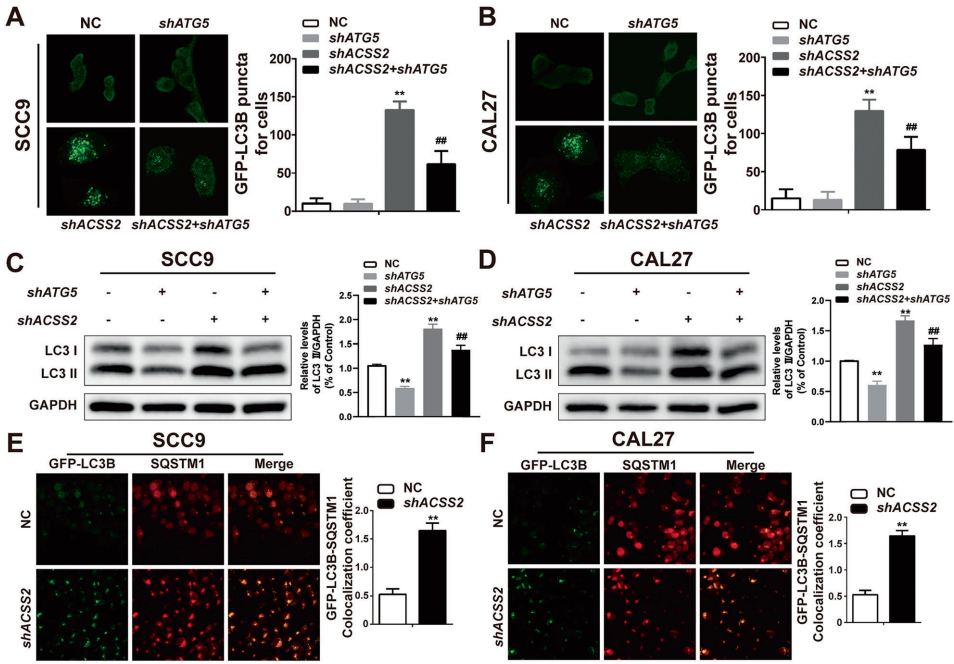
研究通过多维度实验证明ACSS2缺失导致LC3II和p62蛋白累积,但这一现象并非源于自噬体形成障碍(ATG5敲除可逆转LC3II堆积)或自噬体-溶酶体融合异常(LC3-LAMP2共定位未改变)。关键发现是溶酶体膜蛋白LAMP1表达下降50%,同时溶酶体pH值升高、蛋白酶活性降低。
【TFEB的核心枢纽作用】
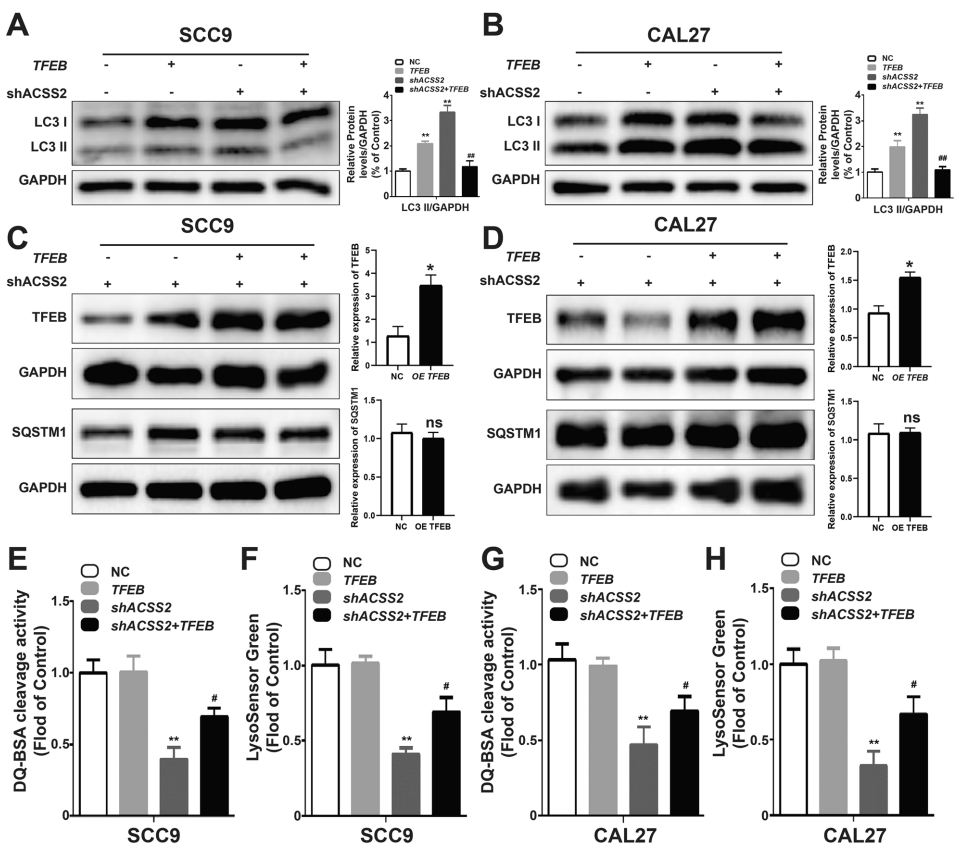
蛋白质组学分析揭示ACSS2敲除使TFEB表达量下降65%。当研究人员在ACSS2缺陷细胞中过表达TFEB时,不仅LAMP1表达恢复70%,溶酶体功能指标DQ-BSA荧光强度也提升2.1倍,更重要的是成功挽救了细胞迁移和侵袭能力。
【动物实验验证】
裸鼠移植瘤实验显示,ACSS2敲除使肿瘤体积缩小58%,而ACSS2抑制剂VY-3-135处理组也观察到类似效果。免疫组化显示实验组Cleaved Caspase 3凋亡标志物增加3倍,增殖标志物KI67减少45%。
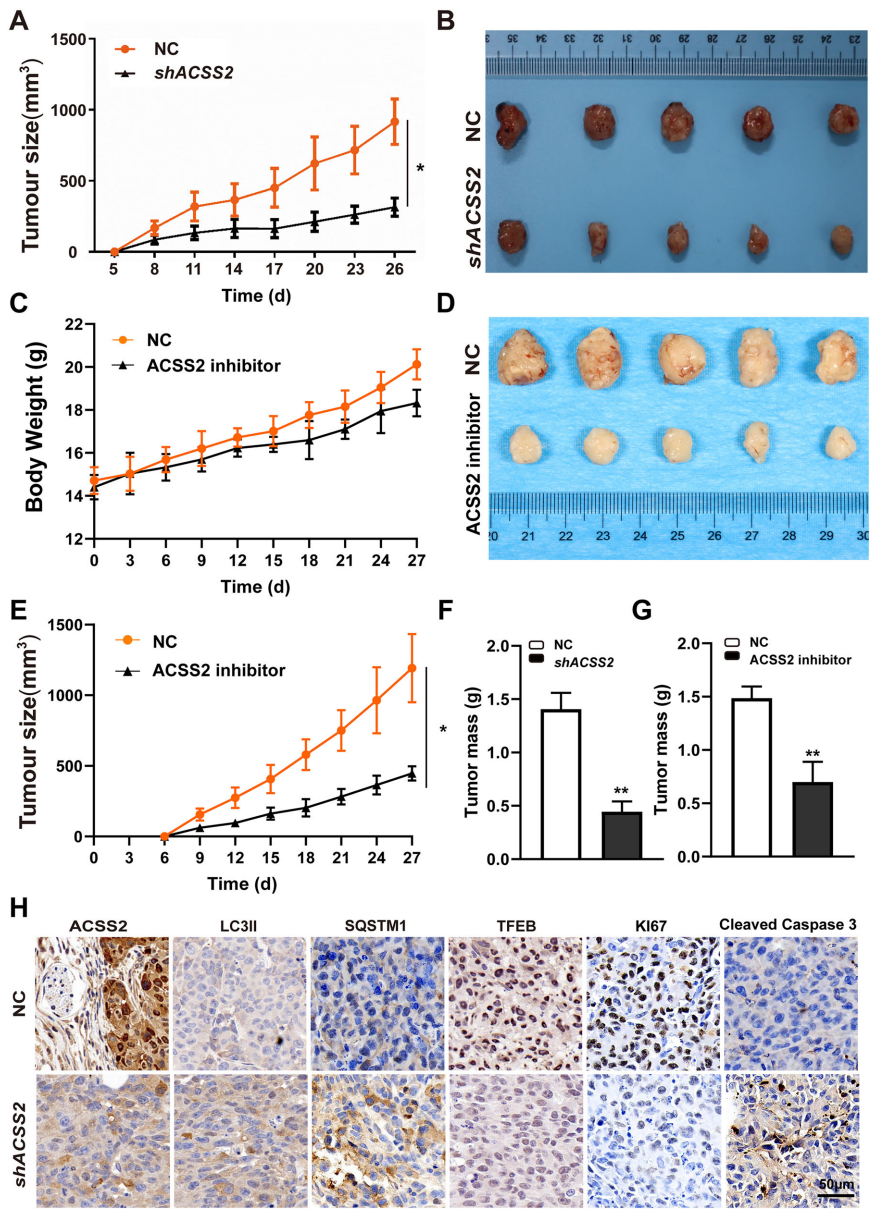
这项研究首次阐明ACSS2通过核转位激活TFEB转录活性,进而协调溶酶体生物发生与自噬完成的分子通路。该发现不仅解释了HNSCC能量代谢重编程与自噬调控的偶联机制,更重要意义在于:①证实ACSS2-TFEB轴可作为预测淋巴结转移的分子标志物;②揭示靶向该通路可同时阻断肿瘤能量供应和自噬保护双重机制;③为开发ACSS2抑制剂(如VY-3-135)与现有化疗的联合方案提供理论支撑。未来研究可进一步探索ACSS2表观遗传调控TFEB的具体方式,以及该通路在HPV阳性与阴性HNSCC中的差异调控特征。
 生物通微信公众号
生物通微信公众号
知名企业招聘