
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:合成生物学启发的减毒活流感疫苗开发
【字体: 大 中 小 】 时间:2025年08月28日 来源:npj Vaccines 6.5
编辑推荐:
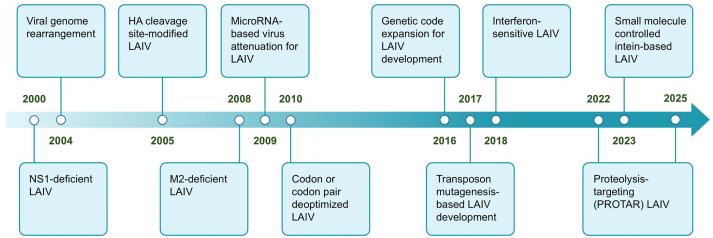
这篇综述系统总结了减毒活流感疫苗(LAIV)的最新研发策略,重点介绍了基于合成生物学的理性设计方法,包括NS1蛋白截短、M2缺陷病毒、基因组重排、HA切割位点修饰、microRNA介导的减毒、密码子/密码子对去优化、遗传密码扩展、转座子诱变、干扰素敏感病毒和小分子调控等9大技术路径,为开发更安全高效的下一代流感疫苗提供了系统解决方案。
流感病毒作为呼吸道传染病的主要病原体,每年导致全球约10亿感染病例和29-65万死亡。根据核蛋白抗原性可分为A、B、C、D四型,其中A型(IAV)和B型(IBV)是引发季节性流感的主要病原。IAV的基因组由8个RNA节段组成,编码包括血凝素(HA)、神经氨酸酶(NA)和基质蛋白(M2)等12种蛋白。
当前流感疫苗主要包括灭活疫苗(IIV)和减毒活疫苗(LAIV)两类。传统LAIV如FluMist通过冷适应传代获得减毒特性,但存在效力不稳定、适用人群有限(2-49岁健康人群)等问题。流感病毒通过抗原漂移和抗原转换持续变异,导致疫苗保护率常低于60%,亟需开发新型疫苗平台。
NS1是流感病毒的关键毒力因子,能抑制宿主I型干扰素(IFN)应答。通过反向遗传学技术构建NS1缺失(ΔNS1)或C端截短(如NS1 1-126)的病毒株,可在干扰素缺陷型细胞中高效增殖,而在正常宿主中显著减毒。
研究表明,单剂NS1 1-99截短的H5N1疫苗可完全保护小鼠抵抗致死剂量攻击。目前三价ΔNS1疫苗已完成I/II期临床试验,显示良好安全性和免疫原性。
M2蛋白的胞质尾区对病毒组装至关重要。通过引入终止密码子删除M2胞质尾区11个氨基酸(M2del11)或完全敲除M2基因(M2KO),可获得复制受限的疫苗候选株。
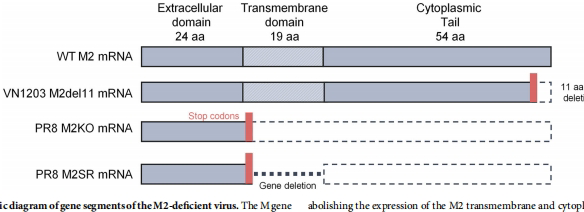
特别值得关注的是M2单次复制病毒(M2SR),其只能在表达M2的互补细胞系中增殖。临床研究显示M2SR能诱导持久的黏膜和血清抗体反应,目前已扩展应用于B型流感病毒(BM2缺陷株)的疫苗开发。
通过改变病毒基因节段的天然排列或插入外源基因,可构建多价疫苗载体。典型策略包括:
PB2基因替换为GFP的复制缺陷型病毒
在H9N2骨架中插入H5 HA基因的双价疫苗
表达额外HA节段的九节段重组病毒
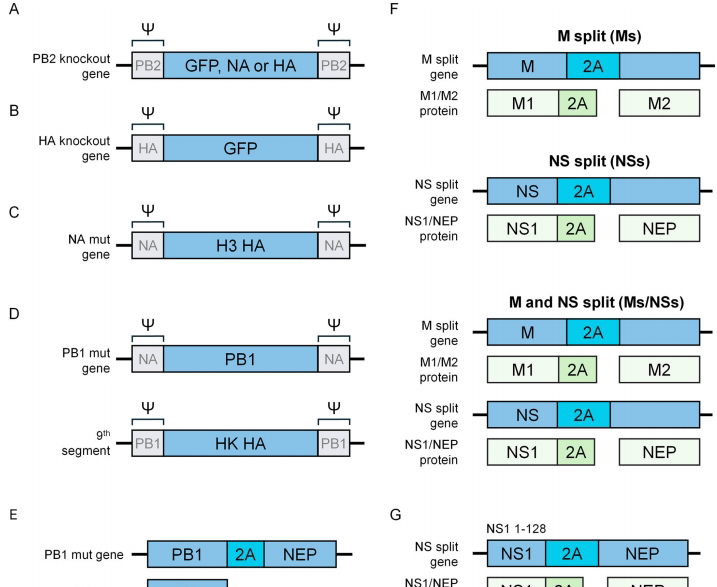
这类设计不仅能实现减毒,还可表达保守抗原表位,增强交叉保护。例如表达H1和H3双HA的疫苗能同时预防两种流行株感染。
HA切割位点修饰:将HA切割位点从胰蛋白酶依赖型改造为弹性蛋白酶依赖型(WSN-E突变体),限制病毒在常规宿主中的复制能力
microRNA介导减毒:在NP基因插入miR-93识别元件,利用组织特异性miRNA实现选择性减毒
密码子去优化:使用宿主非偏好性密码子降低病毒蛋白翻译效率,如NS基因去优化株能在保持抗原性的同时实现稳定减毒
遗传密码扩展:引入非天然氨基酸依赖的终止密码子(PTC-4A),使病毒复制严格依赖转基因生产系统
蛋白降解靶向(PROTAR):在M1蛋白C端添加蛋白酶体靶向降解标签(PTD),通过宿主泛素-蛋白酶体系统调控病毒蛋白稳定性
合成生物学驱动的理性设计正在重塑LAIV开发范式。与传统经验方法相比,这些技术具有三大优势:
安全性:通过多重遗传屏障降低毒力回复风险
广谱性:可靶向保守表位或设计多价疫苗
快速响应:细胞培养平台结合基因合成技术可加速疫苗生产
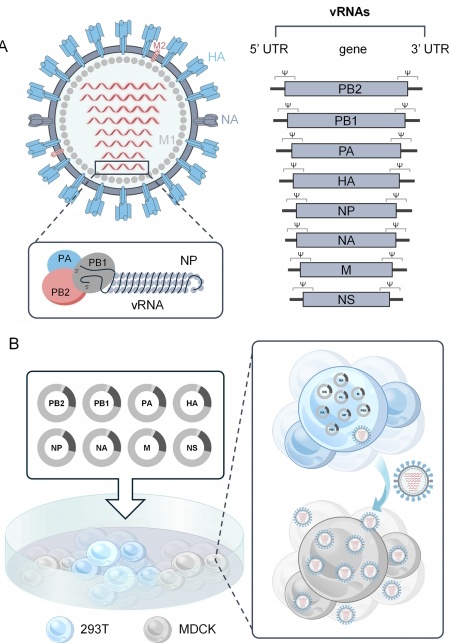
下一代LAIV仍需解决大规模生产工艺优化、特殊人群适用性评估等挑战。随着类器官芯片等新型评价体系的发展,这些创新疫苗有望为流感防控提供更强大的武器。
 生物通微信公众号
生物通微信公众号
知名企业招聘