
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:MDM2在PROTACs中的双重功能拓展了靶向蛋白降解的视野
【字体: 大 中 小 】 时间:2025年08月29日 来源:Biomarker Research 11.5
编辑推荐:
这篇综述深入探讨了MDM2在靶向蛋白降解(TPD)技术中的独特作用,其作为E3泛素连接酶和疾病靶点的双重功能为PROTACs设计提供了新思路。文章系统梳理了MDM2的结构特征、生理病理功能,以及基于MDM2的PROTACs(包括MDM2利用型和MDM2靶向型)在癌症等疾病治疗中的应用进展,特别关注了优化策略(如连接子设计、弹头选择)和新型NCL桥接PROTAC技术。该研究为克服传统E3连接酶(如CRBN/VHL)的局限性提供了创新解决方案。
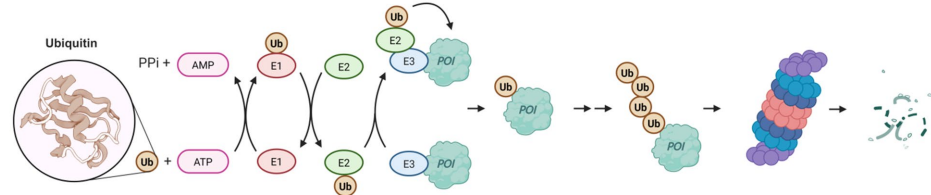
蛋白质稳态(Proteostasis)是维持细胞功能的核心网络,涉及蛋白质合成、折叠、运输和降解的精密调控。当这一系统失衡时,会导致癌症、神经退行性疾病等多种病理状态。靶向蛋白降解(TPD)技术通过利用细胞内天然的降解机制(如泛素-蛋白酶体系统UPS和自噬-溶酶体通路ALP)来选择性清除致病蛋白,其中蛋白水解靶向嵌合体(PROTACs)因其可靶向传统"不可成药"蛋白的优势成为研究热点。
PROTAC分子由三部分组成:靶蛋白(POI)配体、E3连接酶配体和连接子。目前超过98%的PROTACs依赖两种E3连接酶——von Hippel-Lindau(VHL)和cereblon(CRBN),但它们的局限性(如CRBN突变导致的耐药性)促使研究者探索替代E3连接酶。
小鼠双微体同源基因2(MDM2)因其双重功能成为理想候选:
E3连接酶功能:通过K48连接的多聚泛素链标记p53等底物,促使其被26S蛋白酶体降解。其RING结构域需形成同源/异源二聚体(与MDMX)才能激活酶活性。
p53非依赖功能:调控Foxo3A、E2F1/DP1复合物等靶标,参与DNA损伤修复和上皮-间质转化(EMT)。
肽基PROTACs:如靶向雄激素受体(AR)DNA结合域的Au-AR pep-PROTAC,通过金纳米颗粒递送实现DC50≈175 nM的降解效率。
小分子PROTACs:如A1874(BRD4降解剂)通过协同抑制MDM2-p53相互作用和降解BRD4,在p53野生型肿瘤中展现双重疗效。
NCL桥接技术:利用AS1411适体与核仁素(NCL)的结合特性,构建能穿透血脑屏障的"四元复合物"降解系统,如AS1411-V7t1(靶向VEGF165)的DC50达109 nM。
CRBN/VHL依赖型:如口服生物利用度达39%的MD-4251,通过连接MI-1061与来那度胺实现单剂量完全肿瘤消退。
自杀式降解:
Nutlin-3同源PROTACs诱导MDM2自泛素化
冬凌草甲素(Oridonin)桥接的Ori-Ori同时降解MDM2/MDMX
尽管MDM2抑制剂(如ALRN-6924)存在骨髓抑制等毒性,但降解剂KT-253在临床试验中显示出更优安全性。新型NCL桥接技术通过保留MDM2-p53相互作用,避免了传统抑制剂的反馈性MDM2上调问题。
MDM2-PROTACs的独特优势包括:
肿瘤选择性(MDM2在p53野生型癌症中高表达)
多靶点协同(如同时激活p53和降解致癌蛋白)
突破CRBN/VHL的空间限制(可容纳顺式咪唑啉等多种支架)
该领域仍需解决p53突变肿瘤的适用性、组织特异性递送等问题,但MDM2的双重功能已为TPD技术开辟了充满可能性的新维度。
 生物通微信公众号
生物通微信公众号
知名企业招聘