
-

生物通官微
陪你抓住生命科技
跳动的脉搏
蛋白质邻近氨基酸残基对有机荧光团光稳定性的调控机制研究
【字体: 大 中 小 】 时间:2025年08月29日 来源:Communications Chemistry 6.2
编辑推荐:
本研究针对荧光显微技术中荧光团光稳定性不足的核心问题,通过单分子荧光成像和分子动力学模拟,系统探究了蛋白质中半胱氨酸偶联荧光团(Cy3/Cy5/Atto488)的光稳定性与邻近氨基酸残基的构效关系。发现甲硫氨酸(Met)、色氨酸(Trp)等疏水残基会通过缩短荧光团-骨架距离降低光稳定性,而谷氨酸(Glu)能通过延长构象提高稳定性。该成果为优化荧光标记策略提供了分子层面的设计依据,发表于《Communications Chemistry》。
在生命科学研究的微观世界里,荧光显微镜就像科学家的"超级眼睛",能够揭示细胞和分子的动态奥秘。然而,这双"眼睛"的清晰度却受制于荧光染料的光稳定性——当这些微小的发光分子在激光照射下"熄灭"时,关键的生物学信息就可能永远消失。尽管科学家们已经开发出氧清除剂、三重态淬灭剂等"护盾"来保护荧光团,但蛋白质微环境中邻近氨基酸对荧光团的影响机制仍是一块未被充分探索的"拼图"。这正是Yongzhen Hei、Banglong Wang等研究团队在《Communications Chemistry》发表的最新研究要解决的核心问题。
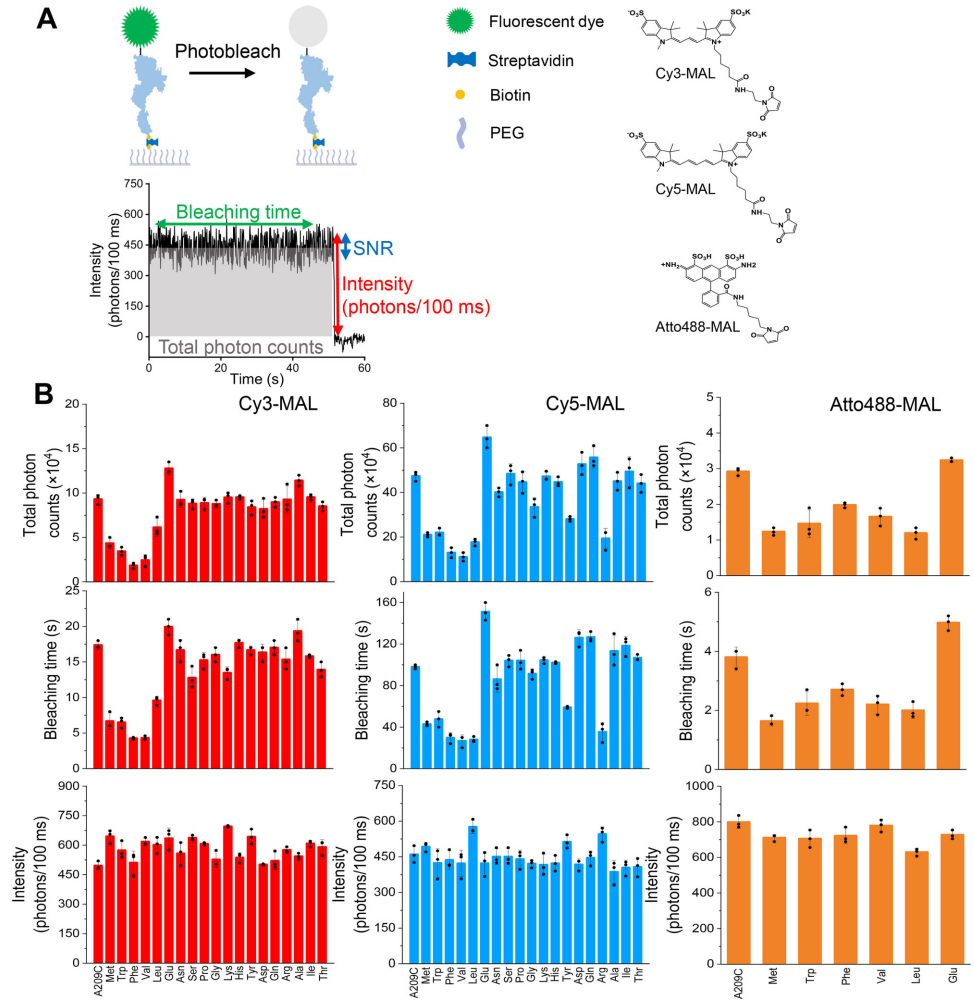
研究团队选择大肠杆菌延伸因子G(EF-G)作为模型蛋白,通过位点特异性突变在其209位半胱氨酸(Cys209)上偶联Cy3、Cy5和Atto488等荧光团。他们创造性地采用单分子全内反射荧光(TIRF)显微镜技术,配合分子动力学(MD)模拟,系统解析了不同氨基酸残基对荧光团光稳定性的调控规律。
关键技术方法包括:1)利用AlphaFold2预测突变体结构并构建荧光标记蛋白;2)通过单分子TIRF显微镜定量分析800余条荧光轨迹的光物理参数(光子总数、漂白时间等);3)采用时间相关单光子计数(TCSPC)测量荧光寿命;4)进行1-2微秒的分子动力学模拟分析局部构象;5)使用Amber20软件包进行力场参数计算和轨迹分析。
Photostability of dyes attached to EF-G-A209C affected by adjacent amino acids
研究发现当Pro208和Asp210突变为Met、Trp、Phe等残基时,Cy3标记蛋白的光稳定性显著降低,总光子数减少40-50%;而Glu突变使光子数增加30%。有趣的是,这些变化几乎不影响荧光强度和信噪比(SNR)。
Influence of adjacent residues in the context of different secondary structures
在α-螺旋/无序区交界处(209位)和β-折叠(308位)位点,邻近残基对光稳定性的调控效应更强。例如在β-折叠区域,Trp使Cy5的漂白时间缩短58%,而Glu延长35%。这表明蛋白质二级结构通过影响局部微环境放大或减弱氨基酸残基的调控作用。

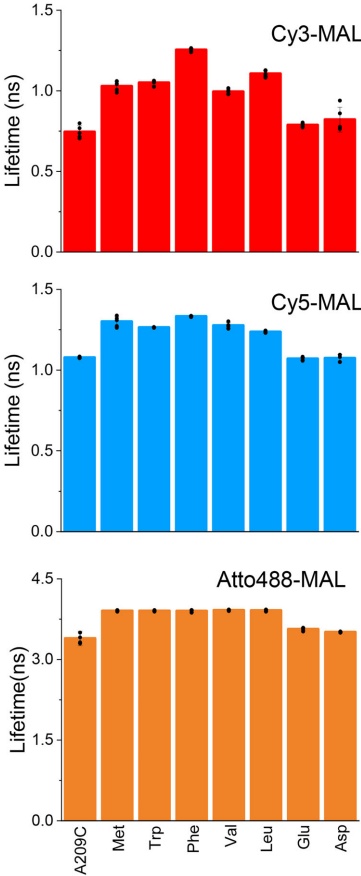
Fluorescence lifetime influenced by adjacent residues
荧光寿命测量揭示出反常现象:降低光稳定性的Met/Trp/Phe反而使Cy3寿命从0.74 ns延长至1.25 ns,而提高稳定性的Glu仅轻微增加至0.79 ns。这表明传统静态/动态淬灭机制不能解释该现象,可能是延长激发态时间增加了光化学反应概率。
Local conformations of EF-G-A209C variants examined by molecular dynamics simulation
MD模拟显示,当荧光团与蛋白质骨架距离<10?时(如Phe210突变体),π-π堆积和空间位阻使荧光团固定于高活性构象;而Glu突变使距离扩展至20-30?,形成保护性"隔离层"。

这项研究首次建立了蛋白质局部构象-荧光团距离-光稳定性的定量关系模型,为理性设计高稳定性荧光标记策略提供了新思路。特别值得注意的是,谷氨酸的稳定化效应为发展"蛋白质工程化保护壳"技术指明了方向。该成果不仅适用于超分辨显微镜(STORM/PALM)等前沿技术,对单分子追踪、荧光相关光谱(FCS)等领域也有重要启示。未来通过人工智能预测最佳标记位点,或将实现荧光标记技术的"按需定制"革命。
 生物通微信公众号
生物通微信公众号
知名企业招聘