
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:钠尿肽受体家族(NPRs)在肿瘤发生发展中的双重调控作用
【字体: 大 中 小 】 时间:2025年08月29日 来源:Cell Death Discovery 7
编辑推荐:
这篇综述系统阐述了钠尿肽受体家族(NPRA/NPRB/NPRC)在肿瘤中的双刃剑作用:NPRA通过VEGF/STAT3等通路促进乳腺癌、胃癌等肿瘤的血管生成和转移;NPRB配体CNP可改善肿瘤血管功能;NPRC则通过PI3K/AKT等通路发挥抑癌作用。文章深入解析了NPs/NPRs系统与肿瘤微环境、代谢重编程的互作机制,并探讨了其作为预后标志物和治疗靶点的转化潜力。
钠尿肽受体(NPR)家族包含三个成员:NPRA(GC-A)、NPRB(GC-B)和NPRC。NPRA和NPRB是鸟苷酸环化酶偶联受体,通过生成第二信使cGMP传递信号;而NPRC主要作为清除受体调控肽类生物利用度。结构上,NPRA/NPRB具有胞外配体结合域、单次跨膜区和胞内催化域,其中NPRA对ANP/BNP具有高亲和力,NPRB则特异性结合CNP。
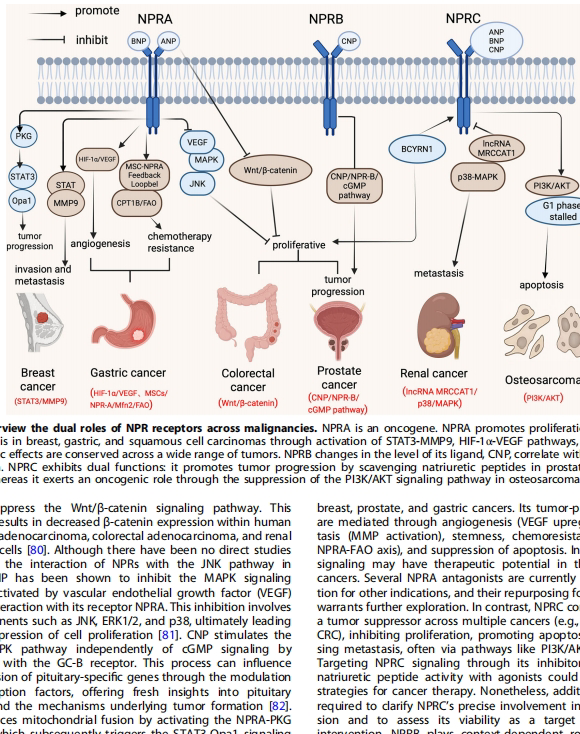
在乳腺癌中,NPRA过表达通过STAT3-MMP9轴增强肿瘤细胞侵袭性,其表达水平与5年生存率负相关。胃癌研究显示,NPRA通过稳定HIF-1α蛋白促进VEGF介导的血管生成,敲除NPRA可诱导G2/M期阻滞和线粒体功能障碍。值得注意的是,ANP对胃癌细胞存在浓度依赖性双向调节:低浓度(10-9 M)通过cGMP-PKG-KCNQ1通路促增殖,而高浓度(10-6 M)则抑制生长。
在前列腺癌中,NPRA通过上调炎症因子MIF驱动肿瘤进展。动物实验证实,NPRA抑制剂NP73-102可显著降低肿瘤负荷。食管鳞癌中,NPRA过表达与MMP2/9激活相关,促进肿瘤侵袭。
NPRB在前列腺癌中呈现组织特异性表达模式——肿瘤组织中CNP/NPRB mRNA水平随病程进展下降,而精浆中CNP浓度反而升高。工程化CNP变体(dCNP)通过增强血管周细胞覆盖、改善内皮连接,使肿瘤血管正常化,显著提高化疗药物渗透率。在胰腺癌模型中,dCNP与PD-1抑制剂联用将治疗应答率从20%提升至70%。
在肾透明细胞癌(ccRCC)中,lncRNA MRCCAT1通过招募PRC2复合体抑制NPRC转录,激活p38-MAPK通路促进转移。骨肉瘤研究显示,NPRC过表达通过抑制PI3K/AKT通路阻滞细胞周期于G1期。肝癌中,lncRNA FENDRR通过吸附miR-362-5p解除对NPRC的抑制,进而激活p38-MAPK促凋亡通路。
NPRA拮抗剂和NPRC激动剂(如C-ANP4-23)在临床前模型中显示抗肿瘤效果。特别值得注意的是,靶向NPRC的纳米探针已成功用于前列腺癌PET分子成像。未来研究需解决:1) NPs/NPRs与Wnt/β-catenin等通路的交互机制;2) 放疗/免疫治疗敏感性调控;3) 液体活检应用可行性等关键问题。

该综述系统揭示了NPR家族成员在肿瘤中的多层面调控网络,为开发基于受体亚型特异性的精准治疗策略提供了理论框架。通过整合血管调控、免疫微环境重塑和代谢干预等多维作用机制,NPs/NPRs系统有望成为肿瘤治疗的新靶标体系。
 生物通微信公众号
生物通微信公众号
知名企业招聘