
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:研究清醒啮齿动物中扩散性去极化影响的最先进临床前技术
【字体: 大 中 小 】 时间:2025年08月30日 来源:The Journal of Headache and Pain 7.3
编辑推荐:
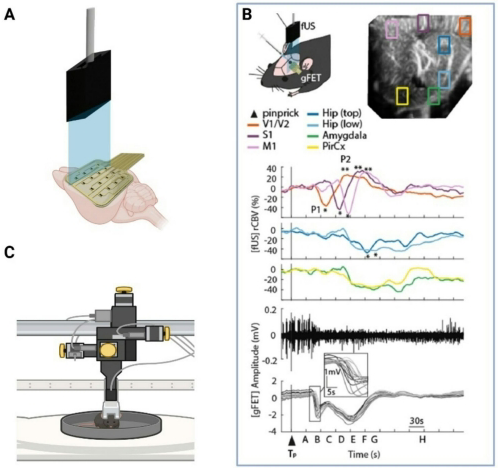
这篇综述系统评述了在清醒(无麻醉)啮齿动物中研究扩散性去极化(Spreading Depolarization, SD)的创新方法,聚焦偏头痛先兆(migraine with aura)模型。作者强调麻醉对SD阈值、血流动力学反应及神经血管耦合(neurovascular coupling)的干扰,提出通过光遗传学(optogenetics)、石墨烯微晶体管阵列(gFETs)、功能超声(fUS)等跨尺度技术实现高精度SD诱导与检测,为闭合转化医学鸿沟提供了关键技术路线。
麻醉作为临床前研究的干扰因素,显著改变系统性(如平均动脉压)和脑生理参数。吸入性麻醉剂(如异氟烷)剂量依赖性地增减脑血流(CBF),而注射型麻醉剂(如丙泊酚)则普遍降低CBF。神经血管耦合的振幅也因麻醉减弱。SD特性(波形、传播速度、阈值)同样受麻醉剂量调控——丙泊酚、氯胺酮抑制SD,而巴比妥类无显著影响。这些干扰促使研究者转向清醒动物模型,以更真实模拟偏头痛、中风等疾病的SD病理过程。
传统电刺激或化学诱导(如KCl)存在侵入性强、靶向性差的缺陷。光遗传学通过光敏离子通道(如ChR2)实现细胞特异性SD诱导,其无线化改进方案可在自由活动小鼠中重复触发SD,同步模拟偏头痛行为(光敏感、异常性疼痛)和血流代谢特征。一项突破性技术结合石墨烯晶体管与光遗传学,实现头固定小鼠非侵入性SD诱导与检测,为研究SD长期影响提供新工具。
直流耦合(DC-coupled)电生理仍是SD检测金标准。传统金属电极因低频响应差易失真,而石墨烯场效应晶体管(gFET)凭借高灵敏度、柔性特点,可穿透颅骨记录SD慢电位(5-10 mV)及传播轨迹(3 mm/min)。深度电极研究揭示SD对皮层各层神经元活动的差异化调控:浅层抑制,深层可能兴奋。阻抗监测作为补充手段,通过组织导电性变化间接追踪SD波。
SD引发特征性血流三相反应:初始低灌注→高灌注→长期低血流(oligemia)。宏观尺度上,功能超声(fUS)可全脑监测血流体积变化,兼容清醒头固定大鼠;介观尺度激光散斑成像(LSCI)和内源性光学信号(IOS)实现皮层宽场血流动态追踪;微观尺度双光子显微镜捕捉到SD诱导的神经元肿胀、树突棘变形及毛细血管血流停滞。一项创新实验通过微型显微镜(miniscope)发现SD后脑脊液中的CGRP直接激活三叉神经节,绕过硬脑膜痛觉传入。
电压成像技术或替代电生理直接光学检测SD,基因编码电压敏感探针与轻量化成像硬件结合,有望实现自由活动动物的全无线SD监测。当前清醒头固定技术虽存在运动伪影和应激限制,但其规避麻醉干扰的优势推动着偏头痛机制研究的范式转变。
跨尺度技术整合(电生理-fUS-光遗传学)正重塑SD研究格局,清醒动物模型将加速偏头痛先兆治疗靶点的临床转化。

 生物通微信公众号
生物通微信公众号
知名企业招聘