
-

生物通官微
陪你抓住生命科技
跳动的脉搏
循环细胞外囊泡通过递送补体C1q促进阿尔茨海默病神经元Aβ42生成的作用机制
【字体: 大 中 小 】 时间:2025年08月30日 来源:Journal of Neuroinflammation 10.1
编辑推荐:
本研究针对阿尔茨海默病(AD)中淀粉样蛋白(Aβ)持续累积的机制难题,发现APP/PS1小鼠血浆来源的细胞外囊泡(APPEVs)通过补体C1q激活神经元JAK2-STAT1-BACE1通路,促进APPβ-切割和Aβ42生成。该研究首次揭示循环EVs通过"外周-中枢"递送途径加剧AD病理进程,为早期干预提供新靶点。
阿尔茨海默病研究新突破:循环囊泡如何成为"病理信使"
在神经科学领域,阿尔茨海默病(Alzheimer's disease, AD)的发病机制始终笼罩着重重迷雾。尽管学界已确认β-淀粉样蛋白(amyloid-β, Aβ)的异常沉积是核心病理特征,但为何Aβ会持续累积形成斑块?近年研究发现,血液循环中的细胞外囊泡(extracellular vesicles, EVs)可能是推动AD进展的"隐形推手",但其具体作用机制仍如盲人摸象。
传统观点认为AD是纯粹的"脑部疾病",但越来越多证据表明外周系统与中枢神经系统存在复杂互动。补体系统作为先天免疫的重要组成部分,其激活产物C1q在AD患者脑脊液中异常升高,却鲜有研究探讨这些免疫分子如何突破血脑屏障(blood-brain barrier, BBB)影响神经元功能。更令人困惑的是,虽然β-分泌酶(BACE1)被公认为Aβ生成的关键酶,但其在神经元中的持续激活机制仍存在认知空白。
Yang Yu和Wenjun Xiao等研究者发表在《Journal of Neuroinflammation》的这项研究,犹如拨云见日,首次系统揭示了循环EVs通过递送补体C1q激活神经元JAK2-STAT1-BACE1信号轴的完整机制。研究团队采用APP/PS1转基因小鼠模型,通过纳米流式细胞术、蛋白质组学和免疫荧光等关键技术,发现疾病相关EVs能携带C1q穿越完整血脑屏障,在神经元内触发级联反应,最终导致Aβ42大量产生。这一发现不仅填补了"外周炎症-中枢病理"间的理论鸿沟,更为AD早期诊断和靶向治疗开辟了新思路。
关键技术方法
研究采用6月龄雄性APP/PS1转基因小鼠和野生型(WT)对照,通过尺寸排阻色谱法(SEC)结合超速离心分离血浆EVs(WTEVs和APPEVs)。利用纳米流式细胞术和透射电镜表征EVs特性,LC-MS/MS进行蛋白质组学分析。通过尾静脉注射DiR标记EVs进行体内示踪,免疫荧光评估血脑屏障完整性。体外实验采用原代神经元培养,通过ELISA检测Aβ42水平,β-分泌酶活性检测试剂盒分析BACE1功能,并运用免疫印迹和共聚焦显微镜观察信号通路激活。
主要研究结果
循环EVs浓度在AD模型小鼠中升高
通过SEC分离的APPEVs表现出典型杯状形态,直径约100nm。纳米流式显示APPEVs浓度显著高于WTEVs,Western blot证实其富含ALIX、CD9等EVs标志蛋白,而线粒体污染标志物Mitofilin呈阴性。

APPEVs通过JAK2-STAT1-BACE1通路诱导Aβ42生成
原代神经元实验显示,APPEVs处理使细胞内和培养基Aβ42水平分别增加2.1倍和1.8倍。机制研究发现APPEVs显著提升BACE1活性和表达量,激活JAK2(Tyr1007/1008磷酸化)和STAT1(Tyr701磷酸化),促进STAT1核转位。免疫荧光证实APPEVs增强APP与BACE1在脂筏标志物GM1上的共定位。
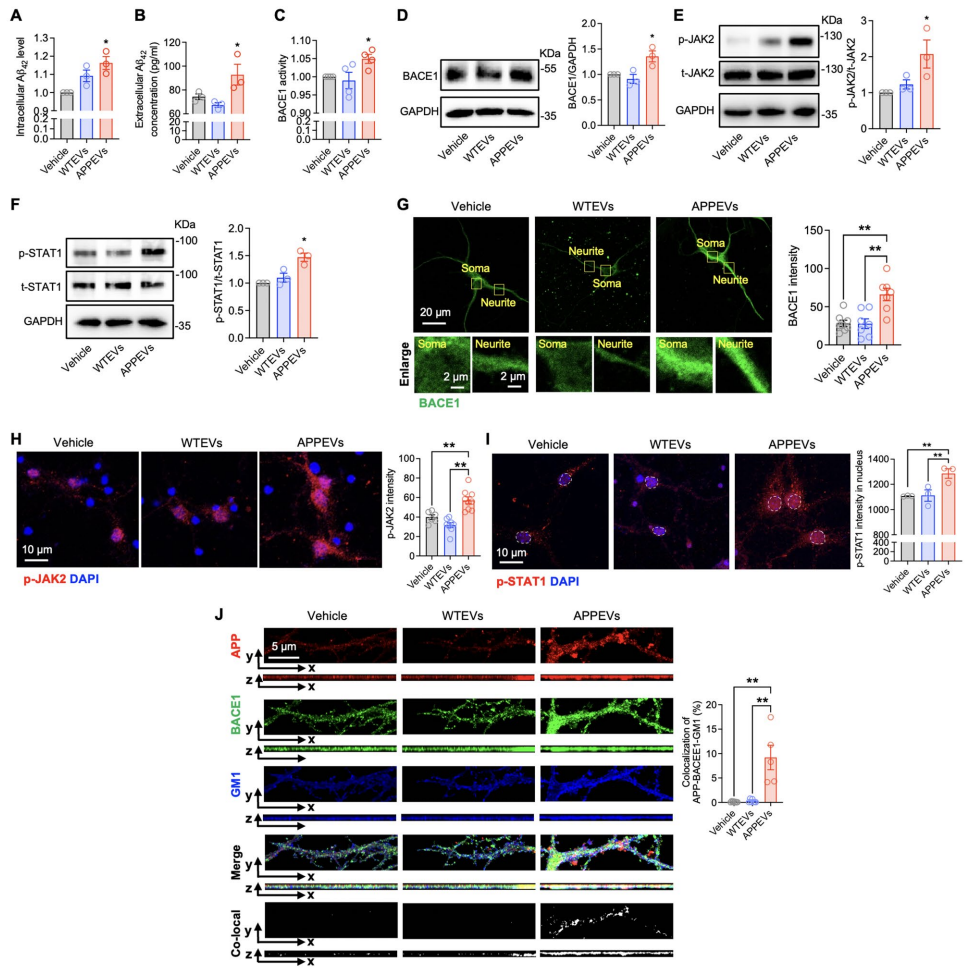
补体C1q是APPEVs中的关键效应分子
蛋白质组学分析显示APPEVs中24种蛋白显著上调,KEGG分析富集于补体与凝血级联通路。ELISA证实APPEVs的C1q含量较WTEVs增加3.2倍。使用C1q抑制剂可完全阻断APPEVs诱导的BACE1上调和Aβ42生成。

APPEVs无损穿越血脑屏障
DiR标记实验显示静脉注射的APPEVs和WTEVs均能进入脑组织,免疫荧光证实其对内皮紧密连接蛋白CLDN1和JAM-A表达无影响,表明EVs通过非破坏性机制穿越BBB。

APPEVs促进体内Aβ斑块形成
在14周龄APP/PS1小鼠中,每周静脉注射APPEVs持续6周后,海马区神经元BACE1表达增加2.3倍,Aβ斑块数量和面积分别扩大1.9倍和2.4倍,该效应可被C1q抑制剂逆转。RT-qPCR显示处理组脑组织C1qa和炎症因子mRNA水平无变化,排除内源性C1q诱导可能。

研究结论与意义
该研究构建了"循环EVs-C1q-JAK2/STAT1-BACE1-Aβ"的完整致病轴,提出三点创新认识:
发现AD模型小鼠循环EVs具有更高C1q载量,确立EVs作为补体系统"分子特洛伊木马"的新功能;
阐明C1q通过激活神经元JAK2-STAT1通路上调BACE1表达的原创机制,破解APPβ-切割持续增强之谜;
证实循环EVs可无损穿越血脑屏障,为"外周-中枢"互作理论提供直接证据。
这项研究的意义不仅在于揭示AD进展的新机制,更开创性地提出:血浆EVs的C1q含量可能成为早期诊断标志物,而阻断EVs-C1q-neuron信号轴或为AD治疗提供全新策略。该成果为理解神经退行性疾病中免疫系统与神经系统的复杂对话提供了范式转变,相关发现已申请专利保护,为后续转化研究奠定重要基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘