
-

生物通官微
陪你抓住生命科技
跳动的脉搏
加速消除HPV相关癌症的创新策略:从疫苗接种到筛查整合的全球实践与模型研究
【字体: 大 中 小 】 时间:2025年08月30日 来源:BMC Proceedings
编辑推荐:
为解决全球HPV疫苗接种覆盖率低(约30%)和筛查覆盖率不足(仅24%使用高性能检测)的问题,研究人员围绕WHO宫颈癌消除目标(90%疫苗接种、70%筛查、90%治疗),探讨了HPV FASTER(联合疫苗接种与筛查)和EVEN FASTER(年轻女性同步干预)等策略。通过模型分析(如印度、卢旺达、巴西的单剂量接种优化)和临床研究(如瑞典队列的R0计算),证实扩展接种年龄、性别中立策略及单剂量方案可显著加速消除进程。该研究为资源分层地区提供了定制化路径,推动全球HPV相关癌症防控的公平性与效率。
人类乳头瘤病毒(HPV)相关癌症的消除是全球公共卫生的重要目标,但现状严峻:全球HPV疫苗接种覆盖率仅30%,筛查项目中仅24%采用高性能检测方法。世界卫生组织(WHO)提出“90-70-90”消除目标(即90%的15岁前女孩接种疫苗、70%的35-45岁女性接受两次HPV筛查、90%的癌前病变患者获得治疗),但实现进度缓慢。尤其在低收入国家,疫苗可及性、筛查基础设施不足及治疗资源匮乏成为主要障碍。此外,HPV感染的复杂生物学特性(如潜伏感染和再激活)进一步增加了防控难度。
研究团队通过多学科会议(2024年HPV预防与控制理事会)整合了流行病学模型、临床试验和公共卫生实践数据。关键方法包括:
数学模型:在印度、卢旺达、巴西模拟单剂量接种与资源分配策略,计算剂量效率与成本效益(如每避免一例癌症所需接种人数NNV)。
队列研究:瑞典HPV EVEN FASTER项目对23-30岁女性同步实施疫苗接种和筛查,评估R0(基本传染数)变化。
生物标志物分析:通过首段尿液(FVU)检测HPV抗体,验证疫苗长期免疫原性。
卫生系统评估:对比墨西哥、哥斯达黎加等国的筛查算法转型(如从细胞学转向HPV检测)。
研究发现HPV潜伏感染可通过免疫抑制再激活(图1),提示成人疫苗接种的必要性。FVU检测显示疫苗诱导的抗体可持续3.5年(84%-100%阳性率),且与血清抗体浓度显著相关(Spearman系数0.36-0.82)。

HPV FASTER:对45岁以下女性联合接种与筛查,可使HPV阴性女性未来筛查需求减少,HPV阳性者加强随访。瑞典模型显示,30%覆盖率即可显著降低感染率。
单剂量接种:在印度,将第二剂量转用于20岁以下女性补种可节省5500万剂,效率优于性别中立接种。卢旺达则需优先覆盖26-30岁女性。
巴西高负担地区通过提高常规覆盖率(50%→90%)可更快实现公平,而卢旺达需结合九价疫苗与筛查。
研究证实,单剂量接种和年龄扩展策略是资源有限地区的优先选择,而高收入国家可通过HPV EVEN FASTER快速降低传播。关键创新在于:
生物学层面:揭示了疫苗接种对潜伏感染的可能抑制作用(如降低病毒再激活风险)。
实践层面:提出“筛查-接种”整合路径(图2),尤其适用于弱势群体(如移民、HIV感染者)。
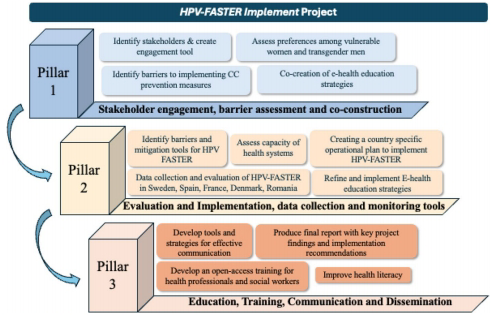
该研究为WHO消除目标的实现提供了科学框架,强调需结合本地化调整(如印度侧重青少年补种,瑞典聚焦同步干预),并呼吁加强政治承诺与技术创新(如点式检测)。成果发表于《BMC Proceedings》,对全球癌症防控政策具有里程碑意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘