
-

生物通官微
陪你抓住生命科技
跳动的脉搏
磷酸化调控Na+/HCO3-共转运体NBCe1失活机制的结构解析
【字体: 大 中 小 】 时间:2025年08月30日 来源:Communications Biology 5.1
编辑推荐:
本研究揭示了SLC4家族重要成员NBCe1-A(Na+/HCO3-共转运体)通过两个磷酸化模块(N端结构域的P-loop和跨膜结构域的H-loop)调控活性的分子机制。研究人员通过结构建模与功能实验证实,P-loop通过结合载体域和支架域抑制转运活性,H-loop则通过与IL3相互作用阻断构象变化。该发现为理解SLC超家族磷酸化调控提供了新范式,对代谢性酸中毒等疾病的治疗靶点开发具有重要启示。
在细胞稳态维持中,溶质载体(SLC)超家族作为第二大膜蛋白家族,承担着离子、代谢物跨膜转运的核心功能。其中SLC4家族的Na+/HCO3-共转运体NBCe1(SLC4A4)在肾脏近端小管介导80%滤过HCO3-的重吸收,其功能缺陷会导致严重代谢性酸中毒。尽管已知蛋白激酶可通过磷酸化调控NBCe1活性,但结构基础始终未明。这项发表于《Communications Biology》的研究,首次阐明了NBCe1-A被磷酸化模块精确调控的分子机制。
研究采用电生理记录、同源建模和位点定向突变等关键技术,以非洲爪蟾卵母细胞为表达系统,结合大鼠脑组织来源的激酶构建体(SPAK/CaMKIIα),系统解析了NBCe1-A的调控机制。
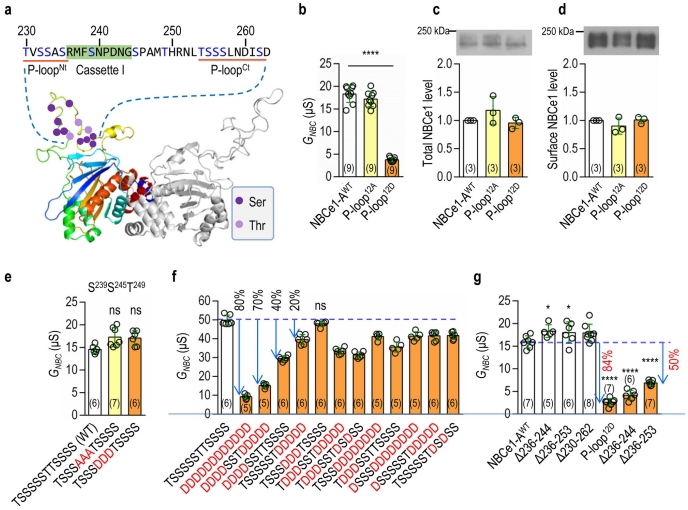
P-loop通过结合载体域和支架域抑制NBCe1-A活性
通过构建P-loop的12个磷酸位点突变体(Ser/Thr→Asp/Glu模拟磷酸化),发现全位点磷酸化可使转运活性降低80%。结构模型显示,P-loop作为N端结构域(NTD)的柔性区域,其N端(P-loopN)和C端(P-loopC)两个磷酸化簇需协同作用才能实现最大抑制。关键发现是:IL4(载体域)和IL3/IL6(支架域)的碱性氨基酸突变可完全消除P-loop的抑制作用,证实磷酸化P-loop通过同时结合两个结构域阻断构象变化。
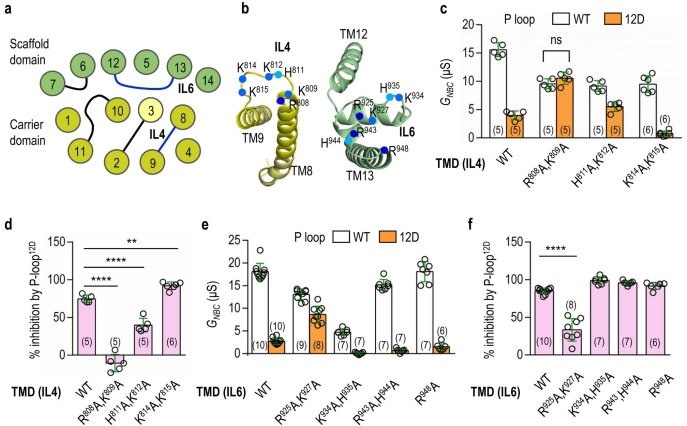
H-loop通过结合IL3实现构象锁定
跨膜结构域(TMD)中的H-loop(含T597/T601/S602磷酸位点)在模拟磷酸化后活性降低60%。结构分析表明,磷酸化H-loop与相邻的IL3(支架域)形成分子内相互作用,阻碍载体域相对于支架域的滑动——这是电梯式转运机制(elevator-like mechanism)的关键步骤。IL3中K371/K421的突变可完全解除H-loop的抑制效应。
生理调控与治疗启示
实验证实内源性PP1(蛋白磷酸酶1)通过去磷酸化维持NBCe1基础活性,而SPAK和CaMKIIα选择性磷酸化P-loop特定位点。该研究不仅揭示了SLC家族磷酸化调控的共性机制,更为开发靶向NBCe1构象变化的治疗策略(如代谢性酸中毒)提供了分子基础。通过精确解析P-loop和H-loop的"分子刹车"机制,为理解SLC超家族动态调控开辟了新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘